ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
CINÉTICA QUÍMICA 2
21. El orden de una reacción química se define como el número de
moléculas que con su concentración intervienen en la velocidad de una reacción
mientras que la constante de proporcionalidad entre la velocidad y la concentración
de estas moléculas, se conoce como velocidad específica de una reacción química
k, término creado por Svante Arrhenius en 1887. Si experimentalmente se observa
que la velocidad de formación de una sustancia C, según la reacción 2A(g)
+ B(g) = C(g), es independiente de B, y cuadruplica cuando se hace doble la
concentración de A, dirás que la expresión de la velocidad de reacción será:
a)
v = k[A][B]
b)
v = k[A]4
c)
v = k[2A]2[B]
d)
v = k[A]2
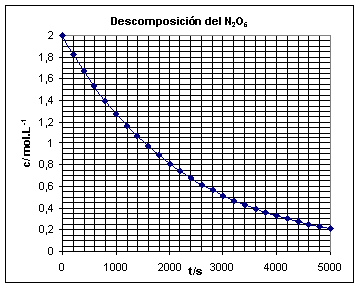
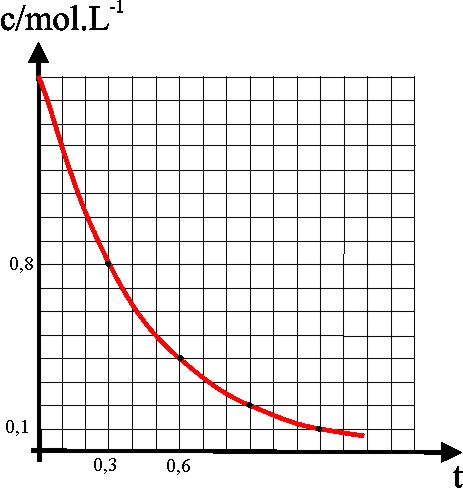
34.La primera
reacción de primer orden homogénea en fase gaseosa estudiada por Daniels y
Johnston en 1921, fue la descomposición del pentóxido de dinitrógeno, en tetraóxido
de dinitrógeno y oxígeno, a 45ºC, reacción que se complicaba bastante al descomponerse
a su vez el tetraóxido de dinitrógeno. Si la gráfica de la variación de la
concentración con el tiempo corresponde a la figura dada, dirás que la velocidad
de reacción al cabo de 3000s es en
mol.L-1.s-1, aproxima-damente:
a) 2,4.10-4
b) 3,2.10-4
c) 4,3.10-4
d) 2,3.10-4
35.De
todo lo que has hecho habrás podido deducir que cuanto menor sea k, la reacción
de primer orden:
a)
Es más lenta
b)
Tiene una
semivida menor
c)
En ella, la pendiente de su gráfica c/t, es mayor
al principio
d)
En ella, la concentración de reaccionante disminuye mas rápidamente
36. En 1864, los profesores
suecos y cuñados Guldberg y Waage, demostraron que la velocidad de una reacción
era proporcional a la “masa activa” de reaccionante. Poco después estudiaron
las velocidades de reacciones sencillas como la esterificación de un alcohol
con un ácido. En estas reacciones la velocidad dependía de la concentración
de ambas sustancias, y por ese motivo deberían ser de segundo orden. En ellas
la variación de la concentración con el tiempo, se representa por una gráfica:

la más correcta es la
a) A b) B c) C d) D
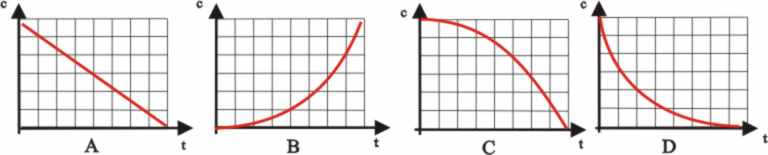
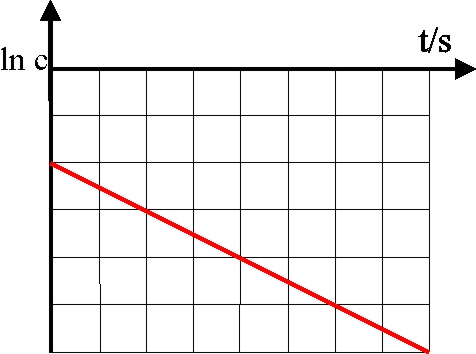
27. Dada la gráfica, para
una reacción de primer orden entre el logaritmo neperiano de la concentración
frente al tiempo, dirás que la pendiente de la misma representa:
a)
La variación de la concentración del reaccionante
b)
El orden de la reacción
c)
La molecularidad de la reacción
d)
La constante de la velocidad
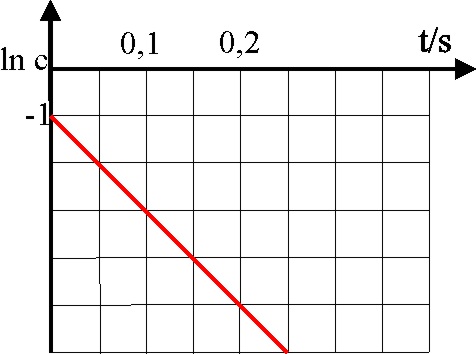
28.En la gráfica dada para
una reacción de primer orden, dirás que la velocidad específica de la reacción
vale en s-1:
a) 10 b)
1
c) -1
d) ln 10
22. Arrhenius interpretó
que la velocidad de una reacción v=kcn, siendo k la velocidad específica
de la reacción o constante de la velocidad, c, la concentración, y n el orden
de dicha reacción, pudiendo ser expresada por una expresión gráfica, con logaritmo
de v, en ordenadas frente a logaritmo de la concentración en abscisas. En
una gráfica así el orden será:
a)
La abscisa para v=0
b)
La ordenada para c=1
c)
La pendiente de la recta
d)
El valor de log v, para log c=0.
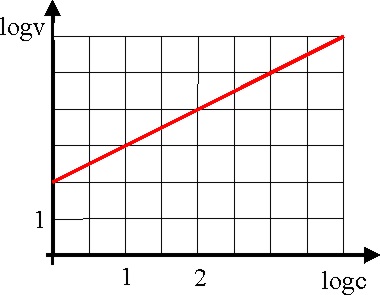
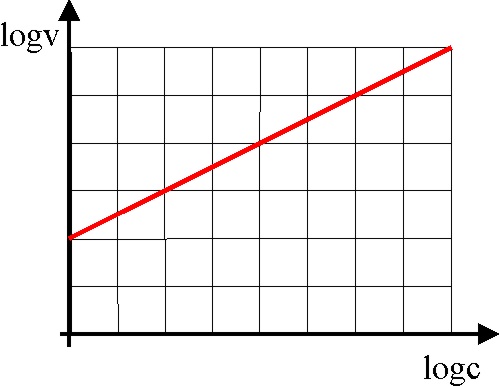
23.Dada la gráfica de la
figura dirás que el orden de la reacción es :
a) 1 b) 2 c) 3
d) 4
mientras que la velocidad
específica de la reacción en unidades del SI, será:
a) 10 b) 100 c) 1 d)
2
24. La determinación del orden
de una reacción química, fue ideada por Van't Hoff, el mismo que introdujo
la isomería etilénica o geométrica y óptica. Si te dicen que en determinada
reacción tabulando los valores del logaritmo de la velocidad de reacción frente
a logaritmo de la concentración de reaccionante, se obtiene una recta que
corta el eje de ordenadas en el punto 0,2 y que tiene una pendiente de 45
grados. Con estos datos en los que las concentraciones vienen en moles/litro,
y las velocidades en moles/litro.hora, dirás que:
El orden de reacción será:
a) 1 b)
2
c) 0,5 d) 0
mientras que la velocidad
específica de reacción en la unidad mencionada será:
a) 2 b) 1,6
c) 5 d) 1
25. La primera reacción
de primer orden que se estudió fue en 1850, por Wilhelmy, y consistió en la
inversión del azúcar de caña (sacarosa) en dextrosa y levulosa, pues su velocidad
sólo dependía de la concentración de la sacarosa, por ese motivo teniendo
en cuenta las dos expresiones de la velocidad de reacción v =k c y v=-dc/dt, dirás que la concentración de reaccionante:
a)
Es inversamente proporcional al tiempo transcurrido
b)
Es directamente proporcional al tiempo transcurrido
c)
Es una función logarítmica del tiempo
d)
Es una función exponencial del tiempo
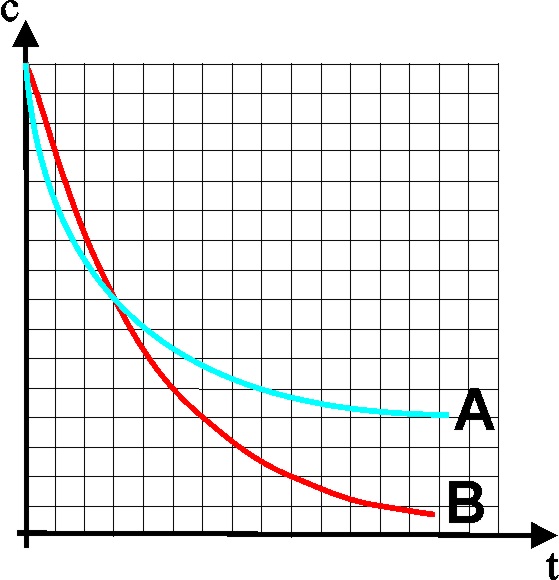
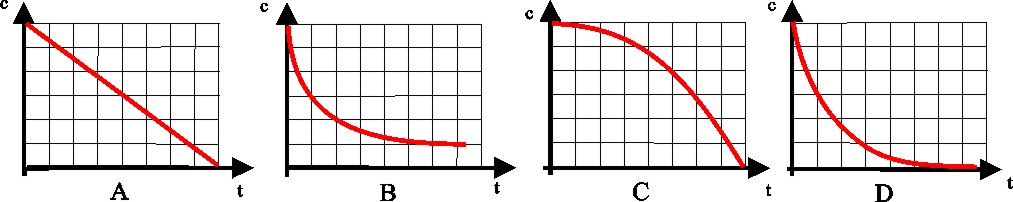
26. De todas las gráficas
dadas que relacionan la concentración de reaccionante con el tiempo para una
reacción del primer orden,
32.La gráfica de la figura
corresponde a la variación de la concentración con el tiempo de una reacción
de primer orden, en ella la semivida será en segundos:
a) 0,3 b)
0,6
c) 0,9
d) 1,2
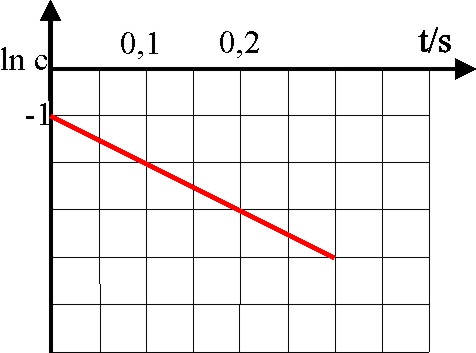
33.En la gráfica dada para
una reacción de primer orden, dirás su
semivida vale, en segundos aproximadamente:
a) 0,1 b)
0,003 c) 0,01 d)
0,035
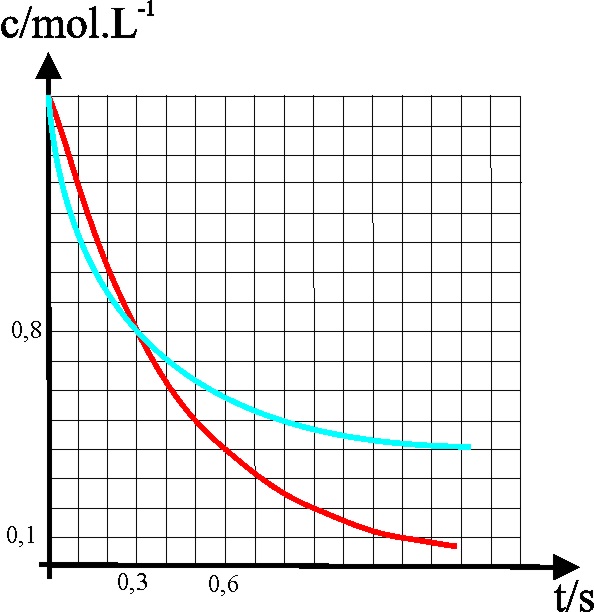
38*. Si te dan la gráfica
con las variaciones de la concentración con el tiempo de dos reacciones A
y B, de las cuales no sabes si son de segúndo y primer orden, podrás asegurar
que:
a)
La de segundo orden es la A
b)
Ambas tienen la misma semivida
c)
Ambas tienen la misma concentración inicial
d)
La más rápida después de la semivida es la de segundo orden
39*. Dadas las gráficas
de la variación de la concentración con el tiempo de dos reacciones una de
primer y otra de segundo orden, con velocidades específicas respectivas k1 y k2, podrás
asegurar que:
a) La semivida de ambas
vale 0,3s
b) La velocidad de reacción
a los 0,3 de la de primer orden es mayor que la de segundo orden
c) La velocidad específica
de reacción de la de primer orden es menor que la de segundo orden
d) La velocidad específica
de reacción de segundo orden es aproximadamente 2, en L mol-1.s-1.
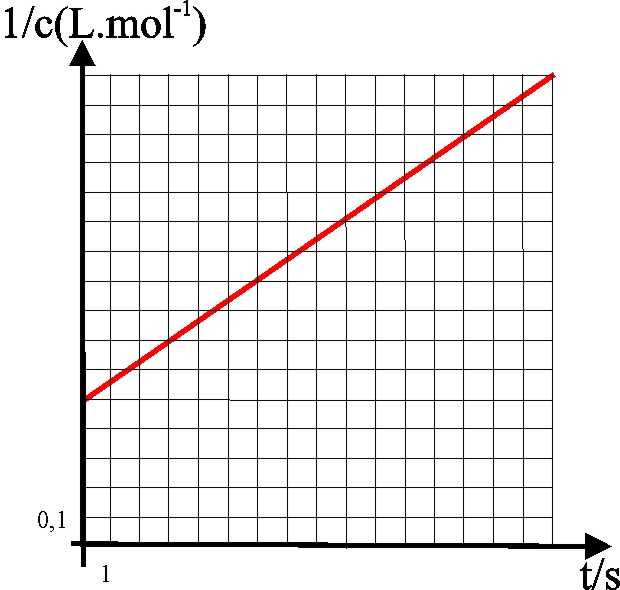
40*. Dada
la gráfica de la figura que corresponde a una reacción de orden dos, se podrá
asegurar que :
a) La concentración
inicial es 0,5 mol.L-1
b) La velocidad
específica de la reacción es 0,075 L.mol-1s-1
c) La semivida
de la reacción es 6,66s
d) La concentración
a los 9s es 0,91 mol.L-1
29. La descomposición del
pentóxido de dinitrógeno, en tetraóxido de dinitrógeno y oxígeno, es una reacción
de primer orden. Si se introducen 5 moles de pentóxido de dinitrógeno en un
recipiente de 10 litros, y al cabo de 1 minuto quedan 1,82 moles, dirás que
la constante de la velocidad será en
s-1, es de:
a)
-1,3.102 b) 1,68.10-2 c) 1,01 d) 1,01.10-2
30*.La semivida de una
reacción química, mal llamada muchas veces vida media, es el tiempo que tarda
una determinada concentración de reaccionante, en convertirse en la mitad,
y en una reacción de primer orden será:
a)
Constante
b)
Dependiente de la concentración
c)
Dependiente de la temperatura
d)
Dependiente del tiempo
31.En las reacciones de
primer orden es muy conveniente conocer la semivida, esto es el tiempo que
tarda en descomponerse la mitad del
reaccionante, dado que es independiente de la concentración. Así si te dicen
que la semivida o vida media de cierto producto que se descompone mediante
una reacción de primer orden vale 10s dirás que la velocidad específica de la reacción
es en s-1:
a) 0,1 b) 1
c) 0,069 d) 0,2
De las dadas, la única
correcta es la a) A b) B c) C
d) D
37*.
La semivida de una reacción de segundo orden,
comparada con la de primer orden:
a) Nunca será constante
b) Siempre será mayor
c) Depende de la concentración
de reaccionantes
d) No depende de la temperatura