
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
121. En todas las civilizaciones, y desde el siglo XII, se han creído inventar ingenios, que se movieran sin esfuerzo externo alguno, eran los móviles perpetuos que surgieron en las ferias, y en las novelas, casi siempre denostadas por los científicos. En 1803, el padre de uno de los científicos mas importantes en el campo de las máquinas térmicas, Sadi Carnot, en su libro” Principios fundamentales del equilibrio y movimiento” manifestaba que el móvil perpetuo era imposible, ello se demostró posteriormente porque:
a) No se cumplía el principio de conservación de la energía
b) No se ajustaba al primer principio de Termodinámica
c) No se cumplía la ley de Hess
d)
No se mantenía constante la temperatura
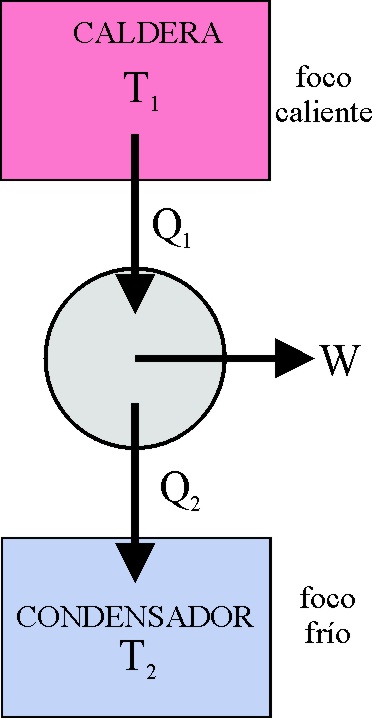
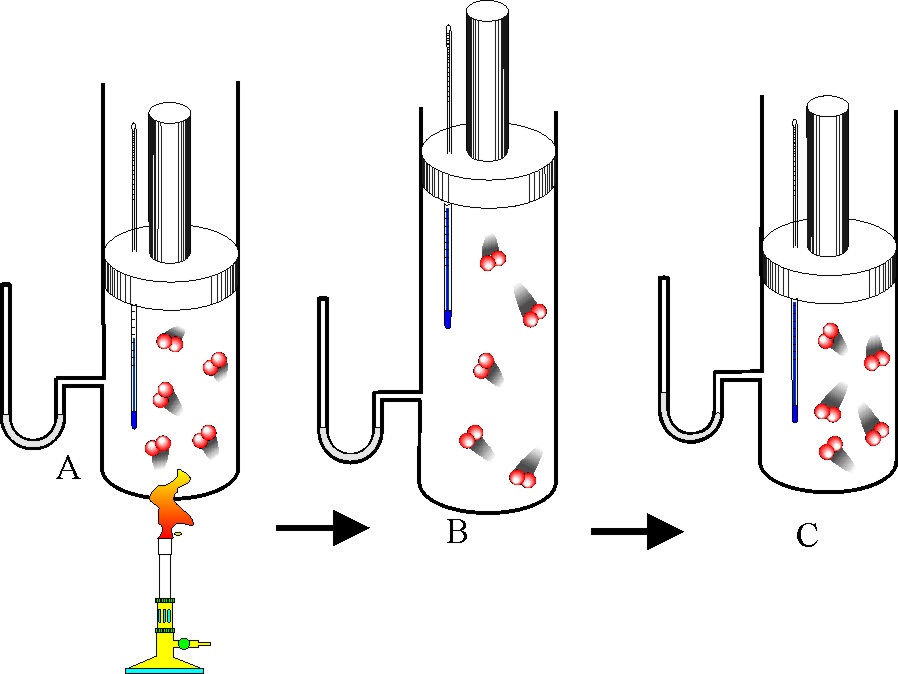
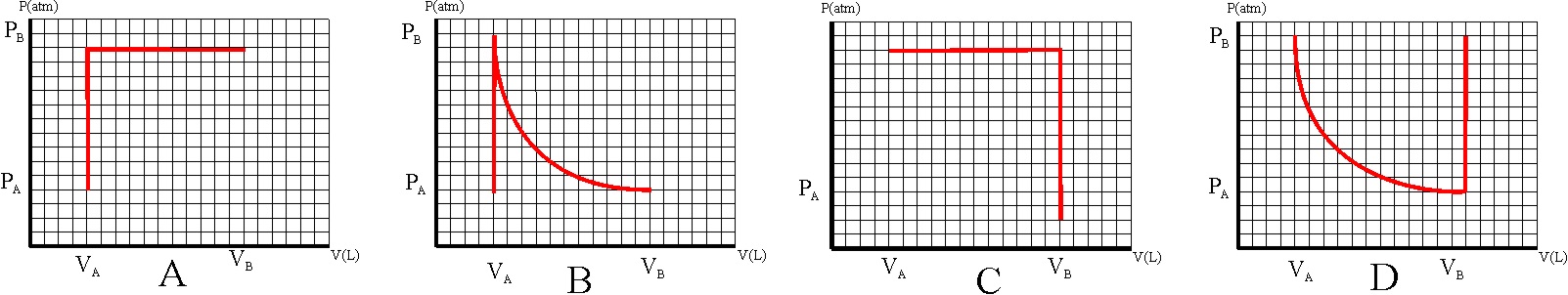
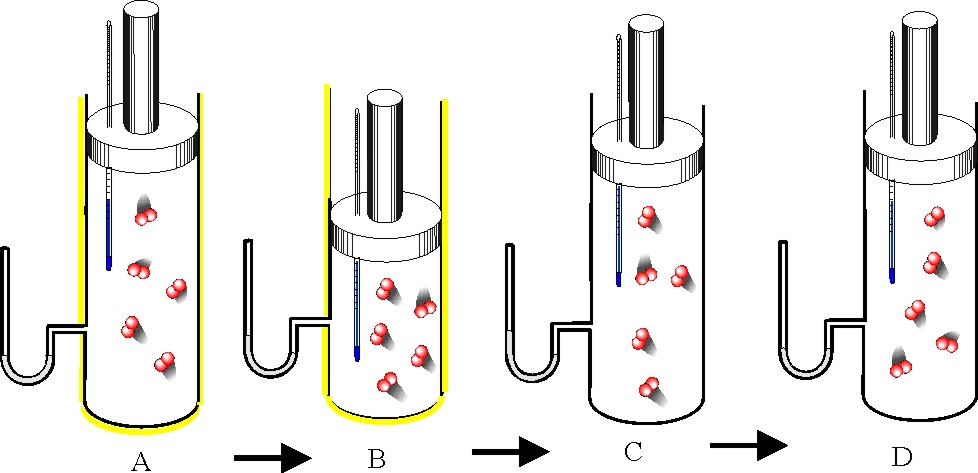
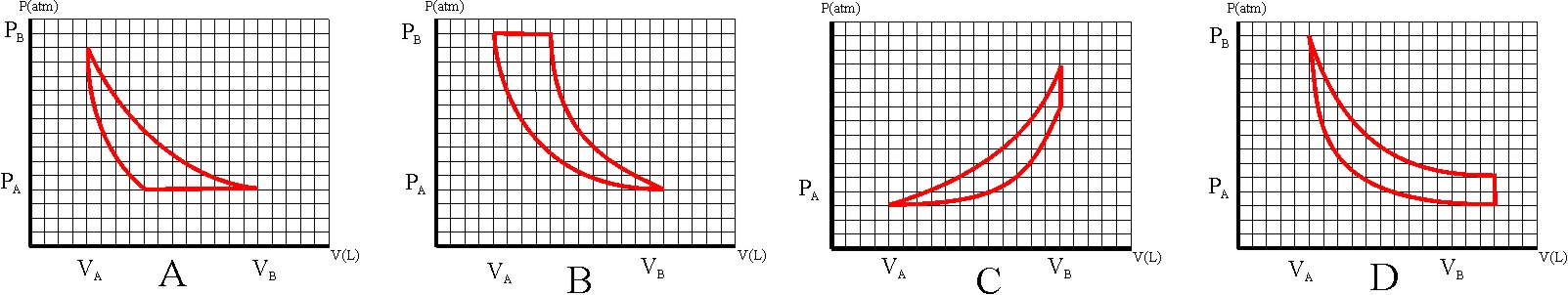
122. Los móviles perpetuos que no cumplían el primer principio de termodinámica, se denominaron de primera especie. Era evidente que el trabajo se podría convertir en calor, por eso nos frotamos para calentar las manos, sin embargo lo contrario no era posible del todo. El dispositivo que lo producía se denominó máquina térmica, en ella:
a) Todo el trabajo se convertía en calor
b) Sólo se convertía en trabajo la energía interna
c) La variación de la energía interna era cero
d) Sólo una parte de la energía calorífica se convertía en trabajo


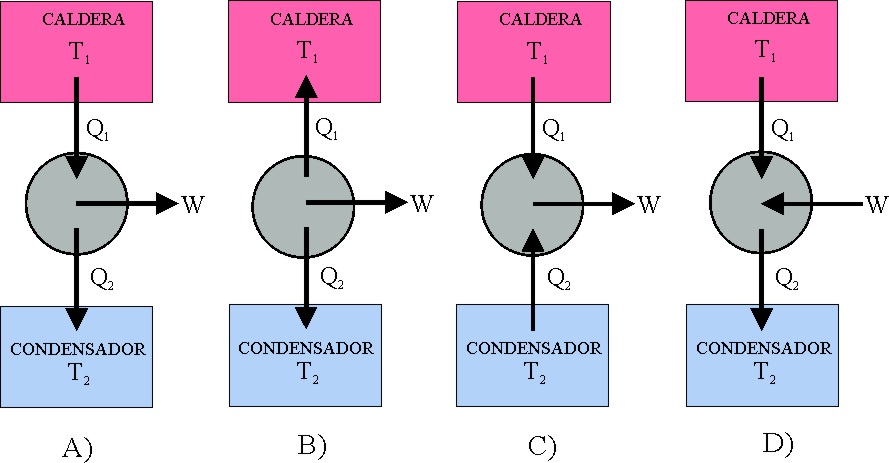
el a) A ;
b) B ; c) C ; d)


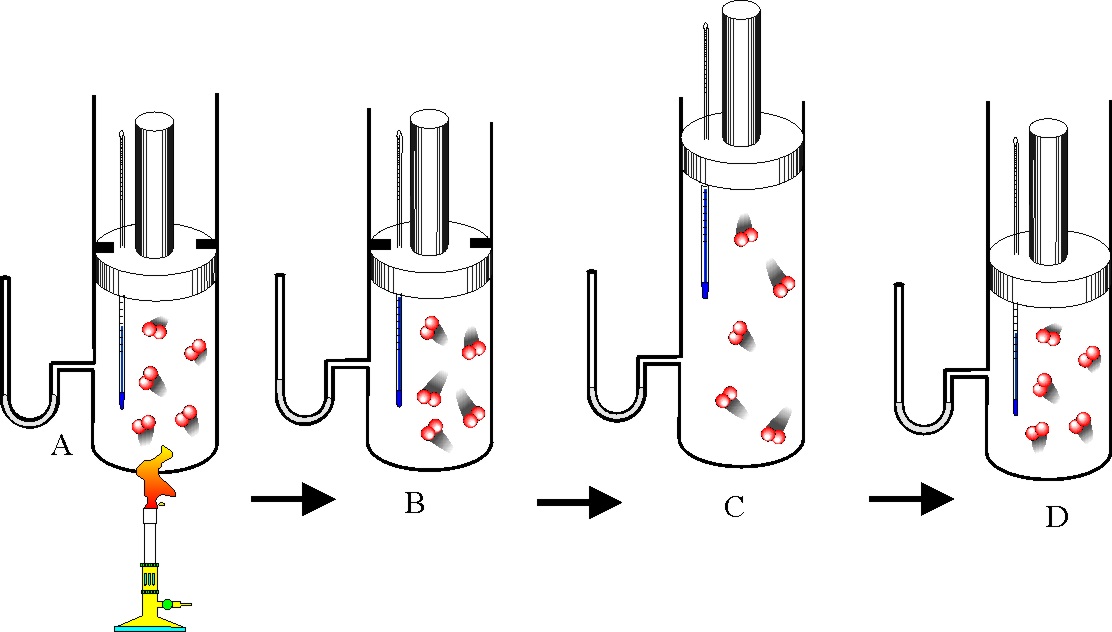
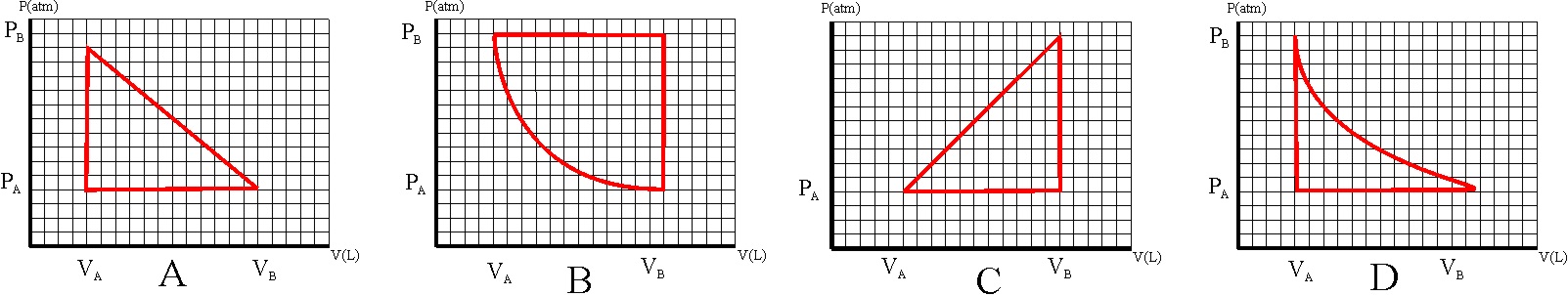
131. Al afirmar la necesidad de
dos focos térmicos con diferente temperatura para que un sistema pudiera transformar
el calor en trabajo, estaba enunciando Carnot, el segundo principio de termodinámica
(uno de los múltiples enunciados), que podría circunscribirse a la imposibilidad
de efectuar trabajo a partir de una sola fuente calorífica. Las máquinas que
no la cumplían se denominaron móviles perpetuos de segunda especie, mientras
que las que incumplían también el primer principio, serían los de tercera
especie. Así si un barco se impulsara únicamente a partir de la energía calorífica
extraída del mar, podría considerarse un móvil perpetuo de:
a) Tercera especie b) Segunda
especie c) Primer especie
132. El ciclo de Carnot
es un ciclo ideal con el máximo rendimiento. Cualquier
máquina en iguales condiciones, lo tendría inferior. Sin embargo el hombre
considerado como una máquina tiene
un rendimiento del 25%, y si se aplicara la fórmula del rendimiento de Carnot,
dado que trabaja aproximadamente entre 37ºC (309K) y 15ºC supuesta temperatura
del medio externo (288K), produciría un rendimiento del
7%, muy inferior al real, lo cual parece una contradicción, sin embargo
se debe a que en el organismo humano lo que se transforma en trabajo es energía
química, mucho más ordenada que la térmica.
| Rendimiento máximo de una máquina |
|
| Máquina de vapor |
15% |
| Turbina de vapor |
35% |
| Motor de gasolina |
30% |
| Motor Diesel |
40% |
En la tabla que se da se observan los rendimientos de diferente máquina, según eso, y teniendo en cuenta que el foco frío está a la temperatura externa atmosférica dirás que la que está a más temperatura es la:
a) Máquina de vapor b) Turbina de vapor
c) Motor de gasolina d) Motor Diesel

136*.Rudolph Clausius introdujo
en 1850, una nueva función termodinámica que primero denominó energía inútil
y después entropía, palabra griega derivada de tropeion, que significa camino
o dirección hacia dentro, que va a medir el grado de desorden en una reacción
química, y la definió de forma que "se pareciera tanto como fuera posible a la palabra energía, puesto que
ambas magnitudes estaban tan estrechamente
relacionadas en su significado físico, que creemos ventajoso la existencia
de cierta semejanza en sus nombres", acuñando el símbolo S para representarla.
La letra S que la simboliza puede indicar
con sus trazos curvilíneos el sentido de giro hacia dentro, por aplicación
de la regla del tornillo. Dado que
el desorden va relacionado con los grados de libertad de un sistema, podrás
decir que un aumento de entropía en un proceso implica:
a) Otro
de energía interna
b) Un aumento del desorden del sistema
c) Una disminución del trabajo efectuado por
el sistema
d) Una disminución de la estabilidad del sistema
138*.Boltzmann, fue un controvertido químico fisico de la universidad de Viena, de carácter genial y depresivo cuyas teorías sobre el comportamiento desordenado de las moléculas gaseosas, no fueron bien acogidas por el mundo científico. Veraneando con su familia en Duino, en la costa del Adriático, se ahorcaría un día festivo, mientras su mujer y su hija se bañaban. En la lápida de mármol de su mausoleo en Viena, realizada por el escultor Ambrosi, sólo aparece una simple fórmula: S= k lnW, siendo W el número de disposiciones diferentes que puede tomar un sistema químico, y k una constante que llevaría su nombre. Las disposiciones diferentes son una medida estadística, sin dimensiones e indicaría
a) La probabilidad de que ocurra un suceso
b) El desorden de un proceso
c) La situación más probable de un suceso
d) La tendencia de un proceso
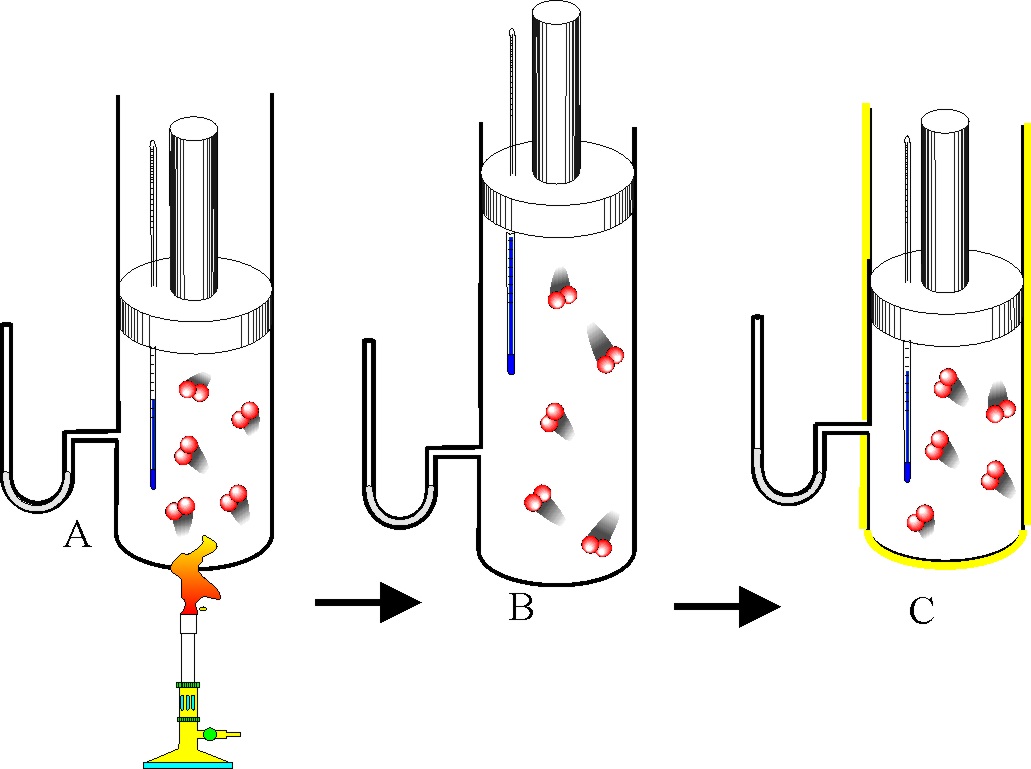
a) Se deja fundir un cubito de hielo que flota
en un vaso con agua.
b) Se condensa formando cristales el vapor de
yodo al enfriarse.
c) Se disuelve un poco de sal común en agua.
d) Se echa agua sobre una disolución de ácido
sulfúrico 2N.
140. En la historia de la termoquímica existen dos físicos con apellidos fácilmente confun-dibles:Thompson y Thomson, que con un intervalo de 30 años, nos dejaron 2 principios termodi-námicos. Benjamín y William, uno norteamericano y otro inglés. Ambos eran conocidos por otro nombre, y alcanzaron la nobleza: lord Rumford y lord Kelvin, respectivamente. Este último tuvo una frase que pasó a todos los textos de termodinámica:"El universo tiende al caos", que resume el segundo principio. Ello era debido a que en un sistema como el universo las transformaciones naturales siempre ocurren a través de:
a) El trabajo desarrollado sea el mínimo
b) La variación de entalpía siempre sea máxima
c) La variación de entropía siempre sea máxima
d) La variación de energía interna sea siempre constante