Termoquímica 6. Ley de Hess. Aplicaciones
(II)
101. Los hidrocarburos
con doble enlace se denominan alquenos, a propuesta de Hoffman, pero antes
se nombraban olefinas, porque "hacían aceite". Esto es debido a
que el eteno gas, adicionaba cloro, formando un líquido oleaginoso denominado
"aceite de los holandeses", conocido ya desde el siglo XIX desprendiendo 219,2 kJ. Si el calor
de combustión del 1,2 dicloroetano es –1072 kJ/mol y los de formación de dióxido
de carbono y agua líquida son respectivamente –393,5 y –285,8 kJ/mol, el calor
de formación del eteno(gas) será aproximadamente en kJ/mol de:
a) –52 b) 320 c) -320
d) 52
102.Como sabes el añil es un color del arco iris del espectro de la luz solar entre el azul y el violeta, derivando su nombre de an-nil, en árabe azul oscuro. Por eso a la amina del benceno (fenilamina), se la denominó anilina, sólido en condiciones normales, que por combustión forma nitrógeno, dióxido de carbono y agua. Si se desprende en ella 3350 kJ/mol, y las entalpías de formación del CO2(g) y del H2O(L), son respectivamente -393,5 y -285,8 kJ.mol-1, dirás que su calor de formación en kJ.mol-1 es aproximadamente:
a) -190
b) 11
c) 190 d)-11
103 La generación de los 1960 a 1980, es la de los
barbitúricos. El ser humano necesita estimulantes para todo. Hasta los alumnos
que preparan un examen la víspera, necesitan estar despiertos aunque después
durante el ejercicio se queden dormidos. Lo que posiblemente no sepas es que
el ácido barbitúrico fue obtenido por Bayer, a partir de la urea, y nombrado
así en honor de su amiga Bárbara que "le quitaba el sueño". La urea
(amida del ácido carbónico) (NH2)2-C=O, sólido se puede
obtener a partir de dos moles de amoniaco gas y dióxido de carbono gas, produciéndose
también agua (l). Si DHf0 de la
urea, agua líquida, amoniaco y dióxido de carbono, gases son respectivamente
en kJ/mol: -149,2/-285,8/-46,1/-393,5 la variación de energía interna en el
proceso será aproximadamente en kJ/mol de:
a) 45 b) -45 c) 58
d)-58
R=8,31 J/K.mol
104.El fósforo existe bajo dos formas sólidas , el rojo y el blanco,
que al reaccionar con cloro gas, producen tricloruro de fósforo. Si el
![]() para el PCl3 es -306 kJ/mol,
si se parte de P blanco, y
para el PCl3 es -306 kJ/mol,
si se parte de P blanco, y
![]() = -288kJ/mol, si se hace desde P rojo la variación de entalpía en la transformación
de P(rojo) a P(blanco), es aproximadamente en kJ.mol-1.
= -288kJ/mol, si se hace desde P rojo la variación de entalpía en la transformación
de P(rojo) a P(blanco), es aproximadamente en kJ.mol-1.
a) 288
b) -18 c) 18 d) -288
105.El acetaldehido o etanal es un producto barato pues se puede obtener del acetileno o etino por hidratación catalizada con sales mercúricas, reacción que se conoce desde 1898, siendo estudiada por Erdmann y Kothner. Si se conocen los calores de formación del etino, dióxido de carbono y agua líquida (226,6 /-393,5/-286 kJ/mol , respectivamente),y el de combustión del etanal líquido,
-1167 kJ/mol, se podrá asegurar que la variación de entalpía en dicha reacción es aproximadamente en kJ.mol-1:
a) -1382 b)
-754 c) -1323 d) -1900
106. En 1929, y en el Rationalis
Annual, un bioquímico inglés, Haldana, explicaba que la primera biomolécula
en la Tierra se había originado a partir de la radiación UV. sobre una atmósfera
reductora de agua, amoniaco dióxido de carbono e hidrógeno. Estas ideas habían
sido apuntadas 5 años antes por el ruso Oparin. Sin embargo el experimento
que confirmó dicha tesis, fue realizado en 1953 en la universidad de Chicago
por Miller y Urey, obteniendo glicina (2-aminoetanoico) e hidrógeno, a partir
de metano, amoniaco y agua. Si DHf0 en kJ/mol:
CH4(g)= -74,8 ;NH3(g)= -46,1; H2O(g)= -241,8
; glicina = -526,3. Dirás que el calor de reacción en kJ/mol será en :
a) -153 b) 253 c) -253
d) 153
107. En 1847, un semidesconocido profesor
de Turín, Ascanio Sobrero, descubrió que al añadir lentamente glicerina sobre
una mezcla de ácidos nítrico y sulfúrico obtenía una sustancia que explosionaba
por simple choque. Este hecho fue aprovechado por Alfred Nobel para a su vuelta
de San Petersburgo, donde había estudiado, montar una fábrica de nitroglicerina
que enseguida voló por los aires con un hermano suyo por delante, en 1864.
La nitroglicerina C3H5N3O9, líquido
pegajoso de densidad 1,59 g/cm3, se descompone violentamente produciendo
12 CO2, 6N2, 10H2O y O2, todos
ellos gases. Si DHf0 de la
nitroglicerina, dióxido de carbono, y agua, son respectivamente –242,1/-393,5/-241,8
kJ/mol, El calor desprendido en la descomposición de 1 litro de nitroglicerina.
Será en kJ aproximadamente:
a) -43200
b)-46200
c) -50000
d) -5000
MASAS
ATÓMICAS RELATIVAS: C=12,H=1,N=14,O=16
108. Se dispone de un compuesto orgánico de composición C=44,6% - H=8,1% - O=43,3%, líquido en condiciones estándar. Si 14,8g. del mismo a 227EC y 1 atm. ocupan 8,2 litros, teniendo en cuenta que los calores de formación del CO2,H2O y el compuesto son respectivamente: -393,5 /-283,8 / -543,4 kJ/mol. La cantidad de agua que sería capaz de calentar de 20 a 100EC, la combustión de 100g. del mismo, suponiendo que no existan pérdidas sería en kg aproximadamente:
a)2 b)4 c)3 d)5
DATOS: MASAS ATOMICAS: C=12/H=1/O=16.
R=0,082 atm.lit./K.mol. Calor específico del agua=4,18 kJ /kg.K.
109.*El cerebro humano medio pesa aproximadamente kilo y medio, y contiene 6000 millones de neuronas, aunque de vez en cuando se le atribuya un contenido específico de serrín. Sin embargo para que no sean "serrín", necesitan consumir oxígeno, siendo el tejido más necesitado (por ello los egipcios para discurrir mejor hacía agujeros en el cráneo a sus sabios). Pues bien, el 25% del oxígeno consumido, lo emplea el estudiante para "discurrir la forma de hacer un examen", dando energía a esas neuronas. Para ello necesita 5,5g.de glucosa por hora. Si cada mol de glucosa libera por combustión 2826 kJ, la energía que consumiría hacer un examen de química de 70 minutos, sería aproximadamente en kJ, de:
a) 100
b) 50 c) 150 d)
200
Podrás asegurar su entalpía de
reacción es en kJ.mol-1 aproximadamente:
a) -100 b)
100 c) -200 d) 200
111. Si la constante total de un calorímetro es 0,6kJ/K y al introducir 1,8g de potasio(s) en exceso de bromo(L), provocando la ignición, se detecta un aumento de temperatura de 30ºC, cuando se forma bromuro potásico, aplicando la ley de Hess, a través del ciclo de Born-Haber y con los datos dados, se podrá asegurar que su energía de red en kJ.mol-1 es aproximadamente:
a) 660
b) 760 c) -760 d) -660
DATOS ENERGÉTICOS EN kJ.mol-1
Entalpía de
sublimación del potasio= 89; Energía
de enlace del bromo= 194;
Electroafinidad
de bromo= -349; Calor de vaporización del bromo=31.
Energía de ionización del potasio=418.
112. Si la constante total de un calorímetro es 0,5kJ/K y al introducir
1g de sodio en exceso de yodo provocando la ignición, se detecta un aumento de temperatura de 25ºC,
cuando se forma yoduro sólido sólido, se podrá asegurar con los datos que
se dan, que su energía de red en kJ.mol-1, vale:
a) 690
b) -590 c)
-690 d) 590
DATOS en kJ.mol-1:
entalpía de
sublimación(Na)= 107,5; energía de enlace I-I= 148;
electroafinidad
de yodo= -308; energía de sublimación
del yodo=62;
energía de ionización de sodio=496. Masa molar del sodio=
23g/mol.
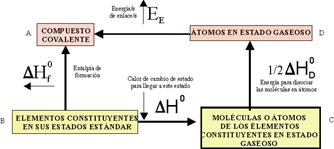
113*. Se ha explicado que para que se estableciera una unión química entre dos átomos, iones,
y moléculas el sistema debería alcanzar
un mínimo energético evaluado experimentalmente a través de la energía de
enlace. Aunque se pueden usar métodos experimentales espectroscópicos, lo
más normal es emplear los calorimétricos,
teniendo siempre en cuenta que la energía necesaria para romper un enlace
(energía de disociación) es numéricamente igual a la energía que se libera
en su formación; solo difieren en el
signo, según el convenio energético. La energía de disociación de enlace estándar habitualmente se define como la variación de
entalpía que ocurre cuando se rompe un mol de un enlace específico, estando
reaccionantes y productos en un estado hipotético de gas ideal a 1 atm. de
presión y 298K, ello da lugar a que
se pueda confundir la variación de energía potencial DU dada a través de las curvas energéticas
de enlace con la variación de entalpía, lo cual sólo ocurre a 0K, pero permite
su cálculo por los métodos indirectos calorimétricos, la conversión entre
ambas implicaría la aplicación del primer principio de termodinámica; DU=DH + RTDn, por eso la energía de enlace
coincidirá con la entalpía de enlace sólo cuando:
a) La variación del número de moles
sea 0
b) La temperatura sea 0ºC
c) No se produzca trabajo en el proceso químico
d) Se alcance un mínimo energético