ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
Termoquímica
3 (Teoría)
41*.Joseph Black, profesor de Química en la facultad de Medicina de la Universidad escocesa de Edimburgo, queriendo determinar los puntos fijos de la escala termométrica, observa en 1762, que la temperatura permanecía constante, cualquiera que fuera la cantidad de calor suministrado al hielo fundente . Hace una serie de experiencias, empleando la escala Fahrenheit, para comprobar el hecho, y denomina al calor desaparecido y que el termómetro no indicaba “latent heat”, o sea “calor latente”. Observa el mismo fenómeno con el agua hirviendo, y explica que el agua combinada con cierta cantidad de calor, constituye el vapor (en aquel tiempo se consideraba al calor como una sustancia química), y a este calor lo denominó por este motivo “calor de combinación”. Ambos constituyen el mismo fenómeno que actualmente se representa por la letra 8, cuando se refiere a un gramo de sustancia que cambia de estado, y que significa la energía empleada:
a) en aumentar la energía interna del sistema
b) en aumentar los grados de libertad de las moléculas del sistema
c) en realizar un trabajo de expansión
d) en realizar un trabajo para
cambiar de estado
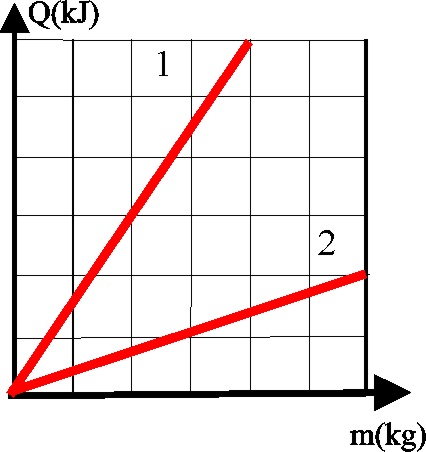
42. El calor latente de cambio de estado, se definiría como la cantidad de calor transferido por unidad de masa que cambia de estado. Si te dan dicha relación para una misma sustancia que cambia de estado sólido a líquido o de líquido a gas, dirás que:
a) La recta 1, corresponde al calor de fusión
b) La recta 1, corresponde al calor latente de vaporización
c) Ninguna de las 2 corresponde al calor latente de cambio de estado
d) La gráfica 2 corresponde al calor latente de vaporización.

43*.Contemporáneo a Black, Crawford, en su libro “Experiencias sobre el calor animal”, supone que los cuerpos adquieren mas capacidad para contener “calórico” en el momento cuando pasan de un estado físico a otro, y lo explica porque cuando pasan de estado líquido al aeriforme, aumenta su volumen y ello hace que consuman cantidad de calórico. Curiosamente esta explicación inicial, hace 250 años, es la misma que la que se da actualmente a los alumnos, para justificar que el calor latente de vaporización sea mayor que el de fusión dado que en dicho cambio de estado al aumentar el volumen:
a) también aumenta el grado de
libertad de las moléculas
b) se separan más las moléculas
c) se rompen más enlaces
d) se rompen enlaces más fuertes
44. Laplace, en 1780, y por lo tanto mucho antes que se enunciara la conservación de la energía, escribía en su “Memoria sobre el calor”, lo siguiente: “En todos los movimientos en los que no se producen cambios bruscos, existe una ley que los geómetras hemos designado como principio de conservación de las fuerzas vivas… si los cuerpos están animados por fuerzas aceleradoras, la fuerza viva es igual a la que tenía originalmente… El calor es la fuerza viva que resulta de los movimientos insensibles de las partículas de un cuerpo, y es la suma de los productos de su masa, por el cuadrado de su velocidad, por eso se deben cambiar los nombres de calor libre, calor combinado y calor degradado, por lo de fuerza viva, pérdida de fuerza viva, y aumento de fuerza viva”. Este párrafo se anticipa a:
a) La conservación del momento lineal
b) La conservación de la energía
c) La conservación del momento angular
d) El teorema de las fuerzas vivas
45. Los físicos no estaban de acuerdo con atribuir al calor latente todos los fenómenos que ocurrían en los cuerpos incluso cuando su temperatura variaba. Black, en una conferencia en Glasgow, en 1763, señala que los cuerpos absorben diferentes cantidades de calor para aumentar su temperatura, un mismo número de grados, y que no se podía considerar consecuencia de su calor latente, que sólo se refería al cambio de estado. El físico sueco Wilke bautiza en 1772, a esta propiedad como calor específico, aunque Crawford, la define como “capacidad para el calor” o capacidad calorífica, y Kirwan elabora la primera tabla de calores específicos, una relación similar es la que aparece en la figura. De ella se puede concluir que:
a) Por lo general los sólidos tienen menor
calor específico que los líquidos
b) Los metales tienen un calor específico muy
alto
c) El agua
tiene un calor específico anómalo
d) Los gases tienen calores específicos menores
que los sólidos
| Sustancia |
Cp/ kJ/K.kg |
| Agua
L |
4,18 |
| Agua
G |
2,00 |
| Agua
S |
2,06 |
| Aceite
|
2,76 |
| Aire |
1,00 |
| Cobre |
0,39 |
| Hierro |
0,59 |
| Aluminio |
0,039 |
| Arcilla |
0,92 |
| Madera |
1,76 |
| Granito |
0,80 |
| Vidrio |
0,83 |
| Porcelana |
1,09 |
| Etanol |
2,42 |
| Celulosa |
1,55 |
| Petróleo |
2,13 |
46. Aunque en principio se consideraron iguales el calor específico y la capacidad calorífica, ésta se define actualmente como la relación entre el calor transferido y la variación de temperatura experimentada, por eso la unidad del sistema internacional de esta magnitud sería:
a) Caloría/ºC b) Julio/K
c) kJulio/ºC d) Kcal/ºF
47*. Si calentamos un objeto metálico, y lo
tocamos nos quemamos, sin embargo la misma masa de agua, calentada el mismo
tiempo, nos permite nadar y encontrarnos bien en ella. La capacidad calorífica
mide la capacidad de la sustancia para almacenar
energía interna, y por lo tanto de recibir o desprender mayor cantidad de
energía calorífica. Por este motivo:
a) Puede medir la
naturaleza de las uniones entre las partículas que la forman
b) Los sólidos como
no pueden almacenar energía, la recibida la emplean para subir su temperatura
c) El agua debido
a los enlaces por puente de hidrógeno que se forman y rompen la tiene muy
alta
d) Los líquidos con
fuerzas de enlace menores que los sólidos la tendrán siempre mayor
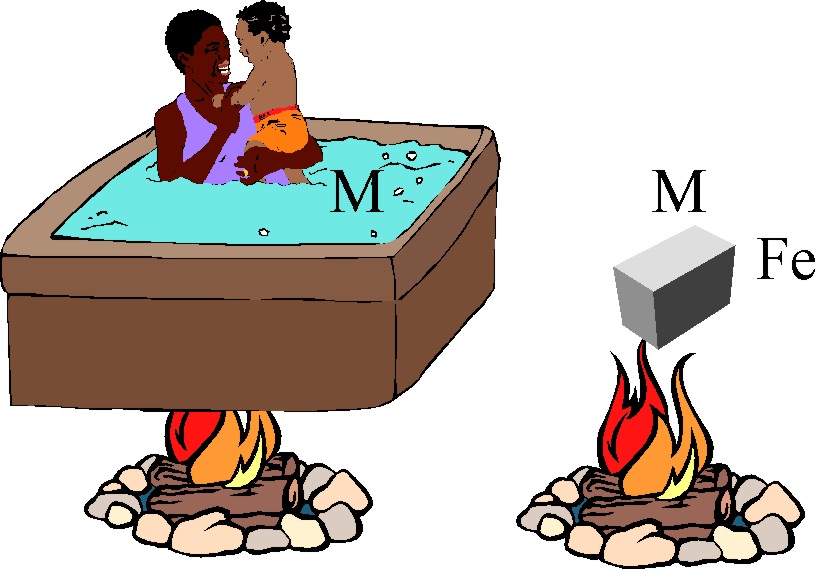
48. En el dibujo de la figura el fuego calienta el mismo tiempo, una masa M igual de agua, en la cual se bañan madre e hijo, y otra M de hierro. Si se te ocurre tocar esta última:
a) No te ocurrirá nada
b) Sentirás la sensación de frío
c) Te quemarás
d) No podrás con ella
49. Naturalmente la capacidad de movimiento depende
del grado de libertad que tengan las partículas que lo forman, y por lo tanto
de la naturaleza de las uniones que se establecen entre las partículas, o
sea de la estructura de la materia que las forman. Por este motivo siempre
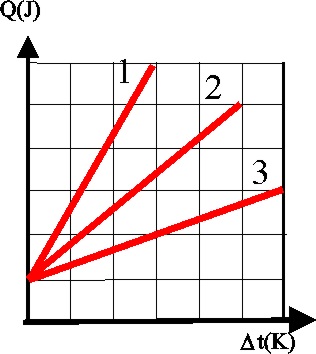
que existan enlaces mas fuertes la capacidad calorífica será menor, y por
ello, generalmente dada la gráfica que relaciona Q y la variación de temperatura
de la misma sustancia en diferente
estado físico, dirás que
a) La 1 siempre corresponderá a su estado sólido
b) La 2 corresponderá al estado gaseoso
c) La 3 corresponderá a su estado líquido
d) La 2 corresponderá a su estado líquido
50. La diferencia actual entre calor específico y capacidad calorífica, es que mientras aquél hace referencia a la unidad de masa que intercambia la energía, ésta última es independiente de ella, y por ese motivo el calor específico se podía definir también como:
a) La capacidad calorífica por gramo
b) La capacidad calorífica multiplicada por la masa en kilos
c) La capacidad calorífica entre la masa en kilos
d) La capacidad calorífica dividida por la variación de temperatura
51. Los conceptos de capacidad calorífica a P constante (CP) y a V constante (CV) para un mol de un gas son muy importantes, ya que permiten relacionarlas entre sí a partir del primer principio de termodinámica, si dividimos las magnitudes que lo expresan por la variación de temperatura, se obtiene una expresión que se conoce como ley de Mayer tal como:
a) CV =CP
+W
b) )U=
CP +W
c) CV =CP +R
d) CV =CP
-R
52. El cociente entre las capacidades caloríficas a P constante y a V constante se define como coeficiente adiabático, que para un gas ideal diatómico valdría:
a) 1,7 b) 1,2 c)
1,4 d) 2
53*.El término ADIABÁTICO
propuesta por Rankine, significa sin intercambio y los sistemas en estos procesos
no intercambian energía (como el caso de un termo), por lo que el primer principio
de termodinámica aplicado a un proceso de este tipo para un mol de un gas,
produciría que :
a) )U=W b) )U= -W c) 0=W+Q d)
CV =RT
54. Los procesos isotérmicos, siempre se realizan muy lentamente mientras que los adiabáticos para que no se produzca el intercambio, deberán hacerse muy rápidamente. Las primeras expansiones adiabáticas fueron estudiadas, en la colaboración entre Joule y el joven Thomson en 1847, expansiones que daban lugar a un notable enfriamiento del sistema, y que serían la base de los frigoríficos, y que justificarían las fuerzas de interacción y las energías de enlace entre las moléculas de los gases Si este hecho lo representamos en una gráfica PV, la ecuación indicada para ello sería:
a) PV=Cte
b) P= cte c) V= cte. d) PV(=cte
55. Si se pretende averiguar como evolucionan
las variables de estado P,V y T en
una transformación isocórica de un sistema gaseoso ideal, tendremos que emplear
la ecuación:
a) P/T = constante b)
PV= constante c) V/T= constante
d) PV(=cte
56. De todos los procesos representados
en un diagrama PV:
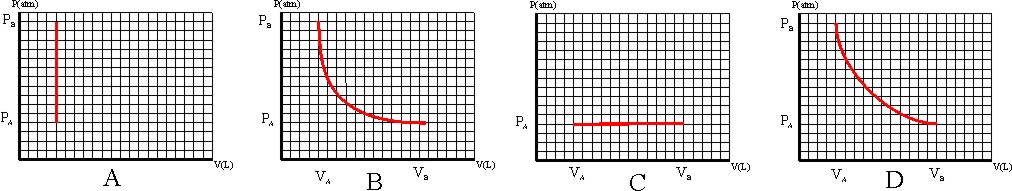
el que corresponde a una adiabática será:
a) El A b) El B
c) El C d) El D
57.La gráfica de una adiabática, se parece bastante a la de una isoterma en un diagrama PV, sólo que aquella tiene una pendiente mayor que para un gas diatómico de comportamiento ideal será de :
a) 1 b) 1,2 c) 1,4 d) 2

a) A b) B c) C d) D
y el sistema evoluciona:
a) aumentando la presión
b) aumentando la velocidad de las moléculas
c) aumentando la temperatura
d) realizando un trabajo
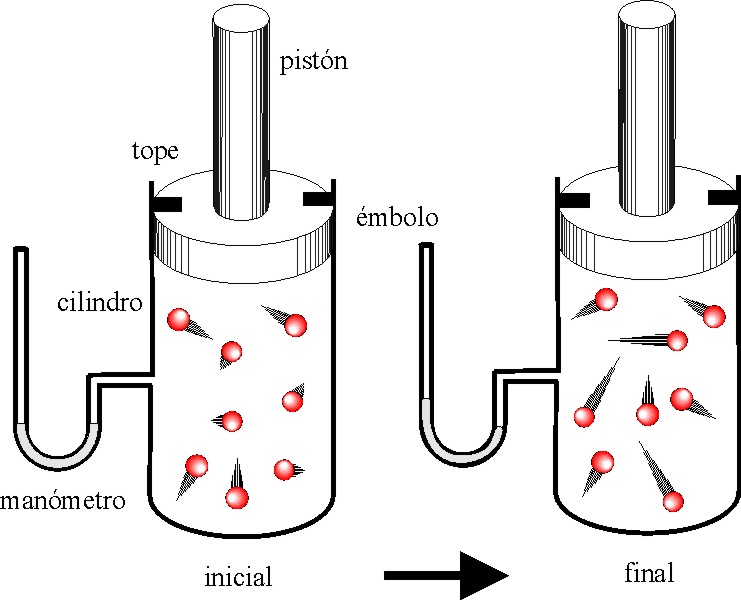
59. Si tenemos un gas monoatómico
encerrado en un cilindro acoplado a un émbolo, y el proceso evoluciona según
se indica en la figura, la gráfica de las dadas que mejor lo representa es
de todas las dadas , la:


a) A b) B
c) C d) D
y la aplicación del primer principio de termodinámica a la evolución del sistema exige que:
a) W=0 b) )U=0 c) )U=)H-P)V d) )U=-P)V
60. Si tenemos un gas monoatómico encerrado en un cilindro acoplado a un émbolo, y el proceso evoluciona según se indica en la figura la gráfica de las dadas que lo representa es de todas las dadas
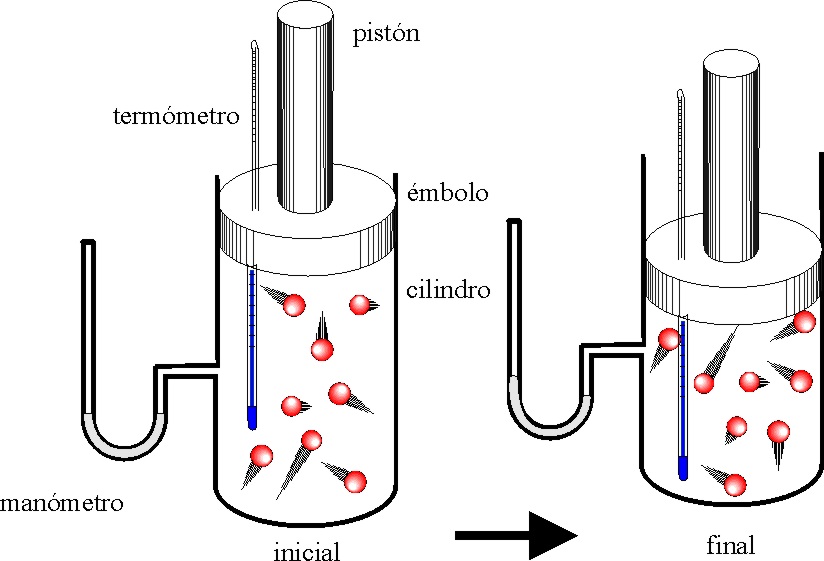

la: a) A b) B c) C d) D
y el sistema evoluciona de un estado a otro de forma que el primer principio aplicado a dicho proceso vendría dado por:
a) W=0
b) )U=0
c) )H=P)V d) )U=-P)V