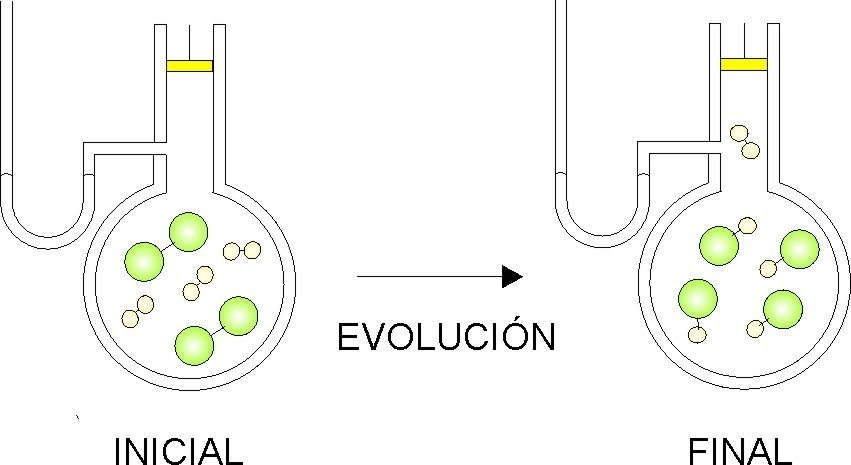
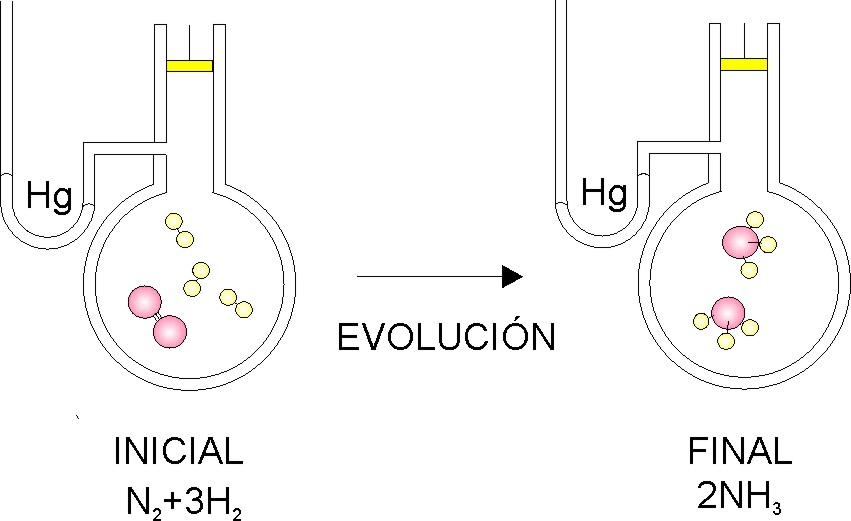
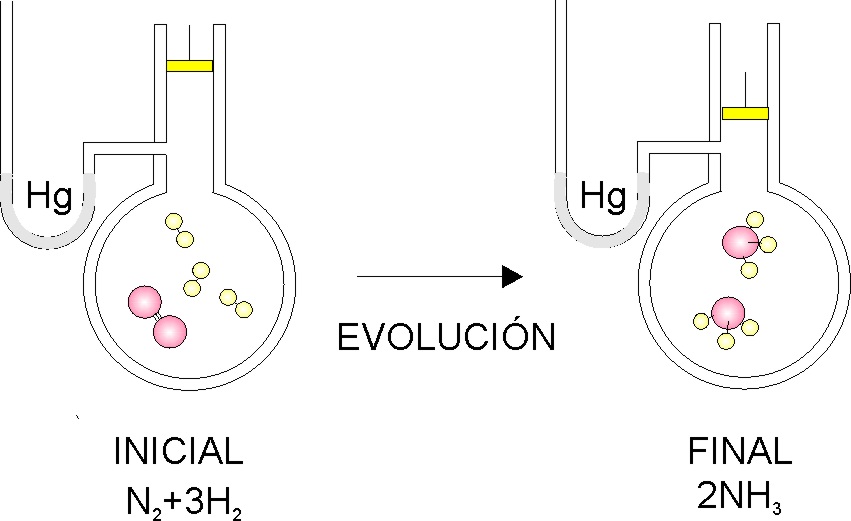
Termoquímica 2 (Conceptos).
Continuación
21.El término ENTALPIA, sugerido por Helmholtz
pero propuesto cuarenta años después,
en 1909, por el holandés Kammerlingh-Onnes, el descubridor de la superconductividad,
procede del griego thalpos (
![]() , calor), con el prefijo
, calor), con el prefijo
![]() que indica interioridad, o sea sería una especie de calor interno, simbolizándose
por error con la letra H que debería corresponder con letra griega ega , si entalpía
se escribiera inicialmente con dicha letra, y no con épsilon , y con la inicial
de calor en inglés (lo cual será simple
coincidencia). La variación de entalpía es una magnitud que representa:
que indica interioridad, o sea sería una especie de calor interno, simbolizándose
por error con la letra H que debería corresponder con letra griega ega , si entalpía
se escribiera inicialmente con dicha letra, y no con épsilon , y con la inicial
de calor en inglés (lo cual será simple
coincidencia). La variación de entalpía es una magnitud que representa:
a) Energía cinética
de las moléculas del sistema
b) Energía potencial
de las moléculas del sistema
c) El calor intercambiado
por el sistema a presión constante
d) La energía interna
del sistema
22*.Inicialmente el contenido
calorífico fue representado por una W, por una I, e incluso por la letra griega
![]() , de forma que
, de forma que
![]() = E+PV. El mismo Gibbs la definió en 1875, como “función calor a presión constante”,
aunque no empleó la palabra entalpía. De esta forma la variación de entalpía
de un sistema representa:
= E+PV. El mismo Gibbs la definió en 1875, como “función calor a presión constante”,
aunque no empleó la palabra entalpía. De esta forma la variación de entalpía
de un sistema representa:
a) El calor cedido por el sistema a sus alrededores
b) El intercambio de energía calorífica entre un sistema y sus alrededores,
a presión constante
c) La variación de energía interna si no se modifica el volumen del sistema
d) El trabajo desarrollado
23.Mayer que
era médico mercante, observó de que
la sangre venosa era excesivamente rojiza en los trópicos como si fuera arterial,
o sea tenía oxígeno en exceso que no era consumido, porque se necesitaba menor
calor animal, por lo tanto quemando menor cantidad de alimento, se podía desarrollar
más trabajo, o sea que el calor y trabajo eran intercambiables. A partir
de este momento y hasta alcanzar la primera mitad del siglo XIX, se produce
una verdadera carrera para calcular su equivalente. Inicialmente el equivalente entre W y Q era de 3,56J/cal,
calculándolo midiendo la temperatura alcanzada por una mesa de agua, cuando
otra caía sobre ella desde una determinada altura. Joule lo mejoró hasta 4,2J/cal
(empleó la escala inglesa y el valor dado es una conversión). Actualmente
está reconocido para la caloría termoquímica
como 4,184J/cal. Los experimentos para calcularlo se basaron en el efecto
que producía sobre una masa:
a) de agua, la caída
de otra masa
b) de hielo, la mezcla
con otra masa de agua
c) de agua, el movimiento
de otro cuerpo
d) de hielo, la fusión
al calentarlo
24. En 1845, Joule decía “Si mis resultados son correctos y la temperatura sube 1º con una caída de 817 pies, la subida de la temperatura en las cataratas del Niágara, supondría 1/5 de grado, para una caída de 160 pies.”. Este hecho implica la conversión de:
a) Energía cinética en calor
b) Energía potencial en calor
c) Trabajo en calor
d) Energía potencial en energía
interna
25*. En 1849, Joule, publica “El equivalente
mecánico del calor”. En ese trabajo presentado en la Royal Society de Londres
se decía que 772 libras –pie de trabajo producirían el calor necesario para
calentar 1ºF, una libra de agua. En unidades no anglosajonas daría un factor
de conversión de 4,154 J cal-1. Según la conversión inicial:
a) La energía potencial
es equivalente al trabajo
b) La energía cinética
es equivalente al trabajo
c) El calor es equivalente
a la energía potencial
d) El calor es equivalente
al trabajo
26 De Rumford, nacido norteamericano de Massachussets, como Benjamín Thomson, y posteriormente convertido en ciudadano inglés y conde de Rumford, se cuentan muchas anécdotas, como la que hace mención a la viuda de Lavoisier, con la que contrajo matrimonio y pronto se separó."Realmente, Lavoisier, al morir guillotinado, había tenido mucha suerte", dijo tras su divorcio. Sin embargo, aparte de destruir teorías obsoletas sobre el calor (T.del calórico) enunció el primer principio de termodinámica que se basaba en:
a) La conservación de las fuerzas vivas
b) La conservación de la energía mecánica
c) La conservación de la cantidad de movimiento
d) La conservación de la energía interna
27.
Aunque quizá, no lo creas,
el inventor de la máquina de hacer café, así como de la sopa de los pobres,
fue el conde Rumford, que de agente secreto británico en la Norteamérica revolucionaria,
y fundador de la Royal Institution
en Londres, llegó a ser el segundo
hombre más poderoso de Baviera. Vida fascinante la suya, que en lo que a la
física concierne, destaca por la interpretación inicial del primer principio
de termodinámica, a partir de la observación del calor desprendido cuando
se forjaban los cañones del ejército de Baviera, cuyo Gran Elector, el equivalente
a rey, le concedió el título de conde. De este principio podrás decir que
su expresión simplificada para un proceso
isobárico e isocórico será:
a) DU=Q+W b) DU=Q-W c) DU=DH+W d) DU=DH
28*.Aunque ya en 1693, el filósofo alemán Leibniz,
había postulado el principio de conservación de la energía mecánica (sin esos
términos). Fue, Helmholtz , el que en 1847, en su trabajo “Conservación de la fuerza”, formula el primer
principio de termodinámica, de forma parecida a como lo conocemos. Sin embargo
la expresión original de éste fue: variación de la energía = calor – trabajo
efectuado, dado que:
a) No se conocía
el concepto de energía interna
b) La energía empleada
era un término genérico
c) El trabajo efectuado lo realizaba siempre el
sistema que evoluciona
d) No se tuvieron
en cuenta los criterios de signos en dicha expresión