ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
TQ-1 (Conceptos teóricos)
1. El calor aparece ya
definido en el Critilo de Platón como engendrado por “el potamiento y el movi-miento”. Esta idea
permanece durante siglos, y Francis Bacon en 1620 lo explica como el movimiento
de las pequeñas partes de un cuerpo. Fue considerado como sustancia de los
cuerpos y hasta se le atribuyó un símbolo químico: fa (aire de
fuego), con las características de un fluido casi sin peso o con ¡peso negativo!
El calor fue considerado durante casi todo el siglo XVIII, como una sustancia
elemental, y así aparece en el Tratado elemental de Química de Lavoisier;
el mejor texto de química hasta el siglo XIX. Sin embargo en la actualidad
se le considera como:
a)
La energía que tiene un cuerpo en cualquier circunstancia
b)
La energía transferida a un cuerpo que se encuentra a menor temperatura
c)
La energía recibida por un cuerpo que se expone al sol
d)
Una forma de energía que posee la materia
2. Aunque no lo creas el término calor, procede
del latín caleo, que no lo hace del griego elio, con referencia al sol, como
creen muchos, pues un cuerpo expuesto a sus rayos, lo sentía, sino de la raíz
indoeuropea keld; caliente. O sea que su origen no tiene que ver nada con
la Física, puesto que el calor no se tiene, y cuando uno lo siente es que:
a) Está perdiendo
energía
b) Está ganando energía
c) Ni se ganas ni se pierde, dado que no tiene que ver con este hecho
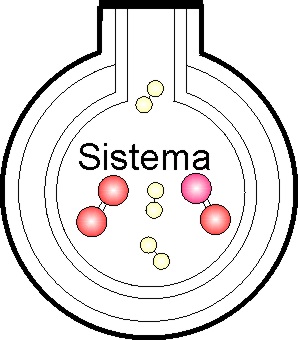
3. Un sistema
es un conjunto de materia que experimenta una transformación, evolucionando
desde un estado inicial a otro final, y que se estudia separándolo de sus
alrededores por una pared, siendo el conjunto del sistema y sus alrededores
el universo donde ocurren los intercambios energéticos. Los sistemas pueden
ser abiertos, cerrados o aislados, según intercambien materia, y energía,
sólo materia o no intercambien nada. Si tenemos un sistema formado por oxígeno
e hidrógeno encerrado en el recipiente de la figura, podremos asegurar que
se trata de un sistema:
a) Abierto b) Cerrado c) Aislado d) No
es un sistema.
11. Como se ha visto para determinar la energía interna de un
sistema hacen falta determinar la temperatura, y para medirla se inventó el
termoscopio y luego el termómetro. El primer termoscopio fue de agua, al parecer
construido por Galileo en 1592, al igual que el empleado en 1631 por el médico
francés Jean Rey y el descrito por el holandés Cornelius Drebbel. 10 años
más tarde se usó el alcohol como líquido termométrico, todos ellos estaban
basados en una propiedad de la materia que
variaba con la temperatura, denominada:
a) Punto de fusión b) Dilatación c) Congelación
d) Sublimación
12*.El termoscopio empleado por Drebbel a principios
del siglo XVII, fue llamado por Bacon,“calendare vitrum”. Consistía en un tubo de vidrio que penetraba en dos recipientes esféricos.
El inferior lleno de agua con agua
fuerte (ácido nítrico), con un poco de aire, que ascendía por el tubo hasta
una determinada altura, según la temperatura. Naturalmente sus medidas no
podían ser muy precisas porque todavía no se tenía en cuenta:
a) La capilaridad
del agua b) La presión atmosférica
c) La densidad del agua
d) La reacción entre
el agua y el ácido nítrico
13. Aunque los primeros puntos fijos que se
tomaron para hacer una escala de temperaturas,
fueron la temperatura de la
nieve y la de la fusión de la manteca, definidos por Dalancé en 1688, Huygens,
había sugerido antes, en 1664, el de ebullición del agua a nivel del mar,
como superior. Y aunque solo en 1694, se fijaron los actuales, Hooke, contemporáneo a Huygens, independientemente
había fijado el inferior de la escala que tomaba como referencia:
a) La congelación
del alcohol
b) La fusión del
hielo
c) La congelación
del mercurio
d) La temperatura
más baja del invierno
14. Newton en 1701, había sugerido numerosos
puntos fijos para realizar una escala termométrica, como la temperatura del
hielo fundente, la de la sangre humana, la de fusión de la cera, incluso la
de fusión de algunas aleaciones de plomo, pero
dado que la mayoría de las medidas inglesas eran antropomórficas (pulgada,
pie etc), también deberían serlo las de la temperatura, y para ello eligió
que se tomara como punto inferior de la escala, la de congelación del agua,
pero como superior la normal del cuerpo humano, dividiéndolo en 12 partes.
Según eso un grado en dicha escala sería:
a) Mayor que la de
un termómetro clínico actual
b) Menor que la de
un termómetro clínico actual
c) Similar a la de
un termómetro clínico actual
15.La escala centígrada, o sea de 100 divisiones
o grados, fue creada en 1710, por el sueco Elvius, pero divulgada por otro
sueco, el astrónomo Celsius, 32 años después, por eso a cada división se denomina
grado celsius. Sin embargo los primeros experimentos de medidas de calor,
a través del invento del calorímetro, hechos por Lavoisier y Laplace, emplearon
la escala del francés Réaumur, de 1730, que tomaba como líquido termométrico
una mezcla de alcohol y agua tal que su volumen aumentara en 0,08 al pasar
del hielo fundido al agua hirviendo. Dicha longitud en el vidrio la dividió
en 80 partes o grados, mientras que Celsius lo hizo en 100, por eso el grado
Reaumur comparado con el Celsius es:
a) ºC=1,8ºR+32 b) ºC=1,8ºR c) ºC=0,8ºR d) ºC=1,25ºR
16. Al inglés Fahrenheit, le cabe el honor de
haber sustituido el alcohol como líquido termométrico por el mercurio, que
se dilataba más uniformemente que el alcohol. Como 0, tomó la temperatura
de una mezcla de hielo y sal, y como 100, la temperatura normal del cuerpo
humano, dividiendo ese espacio en 96 divisiones, de forma que al punto de
ebullición del agua le correspondía el 212 en dicha escala, mientras que el
de congelación del hielo era de 32. Según eso dirás que la equivalencia entre
el grado Fahrenheit y el Celsius es :
a) ºF=1,8ºC+32
b) ºF=1,8ºC-32 c)
ºF=0,8ºC+32 d) ºF=0,8ºC-32
17. En 1842, el físico francés Regnault, crea el termómetro de gas a volumen constante, empleando la dilatación del hidrógeno y a partir de este momento ya se pueden medir temperaturas muy bajas. Doce años después William Thomson, mas tarde lord Kelvin, diseña una escala de temperaturas, con los mismos puntos fijos que la celsius, de forma que la diferencia entre ambos fuera de 100 divisiones en su escala, que llamó escala Kelvin, ello implicaba que el incremento de temperatura en dicha escala era:
a) Igual al de la escala de Celsius
b) Mayor que el de la Celsius
c) Mayor que el de la Fahrenheit
d) Igual que el de la Fahrenheit
18. La primera mitad del siglo
XX, fue una carrera para obtener temperaturas lo mas bajas posible, esto hizo
necesario redefinir las escalas de temperaturas pues los puntos que se habían
tomado como referencia no servían; se necesitaba un único punto, y se tomó
como referencia el punto triple del agua, y la escala redefinida con ese patrón
y fue homologada en la X conferencia del Comité Internacional de Pesas y Medidas,
de 1954, en París, como escala absoluta de temperatura o escala Kelvin, en
honor a este científico, y sus unidades; simplemente kelvin (K). Así un kelvin
equivale a:
a) 1ºC b) 272ºC c) -272ºC d) 274ºC

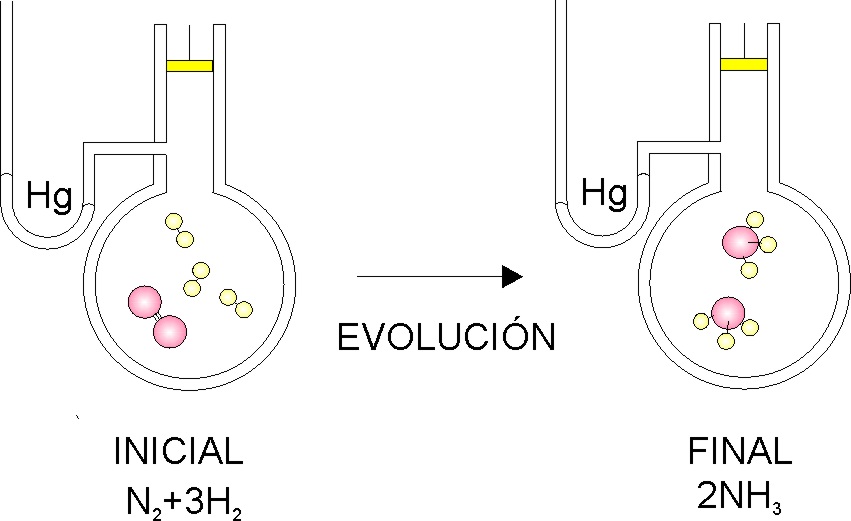
que evoluciona hasta un estado final, en el
que se forma amoniaco, podrás asegurar que en dicha evolución:
a) No varía la masa
por ser un sistema cerrado
b) Varía el volumen
por ser un sistema abierto
c) Varía la presión
porque se producen mas moles de materia y el volumen no varía
d) Varía la masa porque se forma un nuevo compuesto
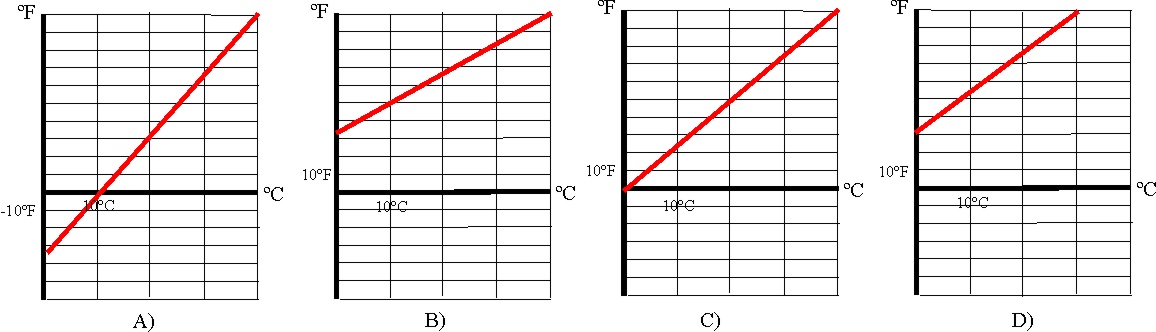
la correcta será la:
a)
A b)B c)C d) D
20. De las gráficas dadas, que relacionan ºF
con el K,
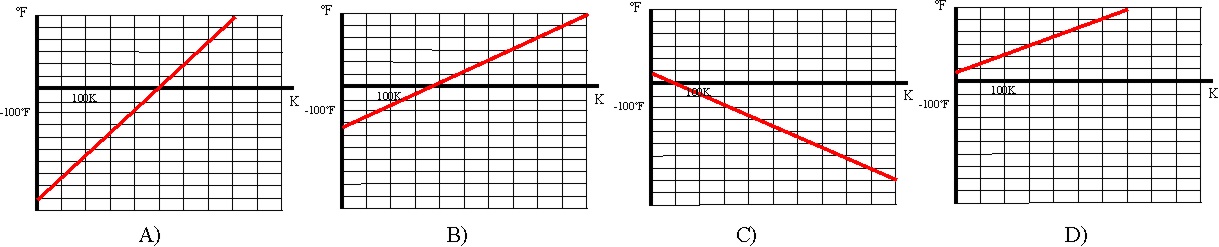
la correcta será la:
a)
A b) B c) C d) D