GRUPO HEUREMA. EDUCACIÓN SECUNDARIA
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
TEST DE QUÍMICA CON ENUNCIADOS
FORMATIVOS
Disoluciones 4
70.En 1748, el francés Nollet, siendo profesor del Colegio de Navarra, adscrito a la Universidad de París, descubre que el alcohol guardado en una vejiga animal (antes muchos reactivos y productos de reacción se guardaban en vejigas animales), se aguaba cuando se sumergía en agua, sin embargo el alcohol no podía pasar hacia donde estaba el agua. Este hecho fue la primera referencia de un fenómenos que casi un siglo después Dutrochet, denominaría ósmosis, significando dos procesos: la endósmosis y la exósmosis, según que el agua pase del disolvente a la disolución, o al contrario En el proceso investigado por Nollet sería:
a) Una exósmosis b) Una endósmosis
c) Exósmosis y endósmosis d) Nada de lo dicho

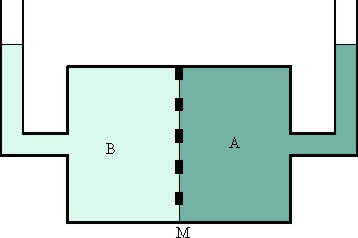
71*.El paso del disolvente a través de una membrana semipermeable (una vejiga), que lo separa de la disolución fue denominada ósmosis por el fisiólogo francés Dutrochet, en 1830, sin embargo este hecho se conocía desde el siglo anterior. Si en el montaje de la figura, una disolución 1M de glucosa (en A), separada por una membrana M, llamada semipermeable 58 años después por van’t Hoff, de otra de la misma sustancia pero 0,1M (en B), observarás que al cabo de cierto tiempo:
a) Las concentraciones de A y B no se alteran
b) Las concentraciones tienen a igualarse
c) La A se diluye y la B se concentra
d) La membrana se deforma hacia A
e) La membrana se deforma hacia B
72*.El término ósmosis, procede de la palabra griega osmos, que significa ímpetu, porque era lo que poseían las moléculas de disoluciones mas diluidas para pasar a través de las membranas, hacia las más concentradas. Por eso la explicación de dicho comportamiento fue realizada por Van’t Hoff, comparándolo con la de los gases que colisionan con las paredes del recipiente que los contiene, efectuando una determinada presión en este caso mayor que la que pueda realizar la disolución mas concentrada, cuyo soluto es inerte. Según lo expuesto anteriormente y lo que sabes del fenómeno de la ósmosis dirás que se produce cuando:
a) Pase soluto a través de la membrana semipermeable
b) Pase disolución a través de la membrana
semipermeable
c) Se modifique la densidad de la disolución
d) Pase disolvente a la disolución menos concentrada
a la más concentrada
e) Se modifique la concentración de las disoluciones
de las disoluciones a ambos lados de la membrana.
73. Thomas Graham descubre en 1854, que ciertas disoluciones de sustancias, llamadas coloides, no podían pasar a través de membranas animales que si eran permeables al agua. La clave de la ósmosis es la membrana semipermeable como lo son la mayoría de las membranas animales, paredes celulares etc. En todas ellas sólo se permite:
a) El paso de moléculas, o iones del soluto
b) El paso de moléculas de disolvente
c) El paso de iones del disolvente
d) El paso unidireccional de moléculas de disolvente
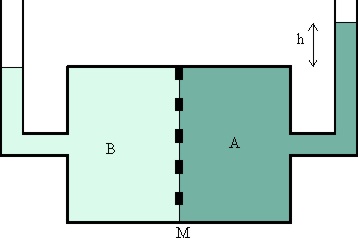
74. Se define la presión osmótica como el exceso de presión que se debe aplicar a una disolución para impedir el paso a ella del disolvente, cuando ambos se encuentran separados por una membrana semipermeable. En el caso de la figura, el disolvente es B y la disolución A. Por lo tanto, si recuerdas la presión que ejerce una columna de líquido de densidad d, y siendo R la constante de los gases, la presión osmótica vendría dada por:
a) hdT b) hdg c)
hRd
d) hRT
e) Ninguna de las expresiones
dadas
75. El 10 de diciembre de 1901, se lee el siguiente comunicado en la Real Academia sueca: “Esta Academia ha concedido el Premio Nobel de Química a Jacobus Henricus van’t Hoff, Profesor de la Universidad de Berlín por sus trabajos pioneros en dinámica química y presión osmótica en soluciones. Como resultado de sus investigaciones en el campo de la teoría atómica y molecular, van’t Hoff ha hecho los más importantes descubrimientos en química teórica desde los tiempos de Dalton”. Así se leyó la primera concesión del Nobel de Química. La fórmula para determinar la presión osmótica, también llamada fórmula de van’t Hoff, presión osmótica B= MRT, la obtiene a partir de los experimentos realizados por Pfeffer, y se aplicará con los valores de R, la constante de los gases y T la temperatura absoluta, para disoluciones de sustancias no electrolitos. Así si tienes un compuesto orgánico que en estado gaseoso ejerce una presión de 700mmHg, a 127ºC, cuando está encerrada en un contenedor de 8L de capacidad, y ese misma cantidad de compuesto disuelto en agua, hasta formar un litro de disolución , a 27ºC, ejercerá una presión osmótica en atmósferas de aproximadamente :
a) 4,5
b) 5 c) 5,5 d) 7,5 e) Ninguno de los valores dados
DATOS: R= 0,082 atm.L K-1. mol-1
76. En 1886,
Van’t Hoff, escribe: “Toda materia disuelta ejerce sobre una pared
semipermeable una presión osmótica igual a la presión que sería ejercida en
el mismo volumen, para un número igual de moléculas en estado gaseoso.”Por
eso la fórmula que da para la presión osmótica es B=
MRT, que podía sustituirse a todos los efectos por B=
mRT, con lo cual se manejaba la misma expresión
de la concentración que en la ebulloscopía y crioscopía. Si se prepara
una disolución al 5% de glucosa, a 27ºC, dirás que su presión osmótica en pascales será aproximadamente de
a) 6,3.105 b) 7,3.105 c) 8,3.105
d) 5,3.105 e)Ninguno de los valores dados
R=8,31 J K-1.mol-1
.Masa molar de la glucosa=180gmol-1
77. La sustitución de la molaridad por la molalidad para disoluciones diluidas, permite conocer la presión osmótica si se calcula el descenso crioscópico para la misma disolución así si sabes que una disolución de sacarosa provocó un descenso crioscópico de 1ºC, podrás asegurar que esta misma disolución tendrá una presión osmótica a 17ºC, en atmósferas de :
a) 12 b) 12,8 c) 13 d) 6
e) Ninguno de los valores dados
DATOS: R= 0,082 atm.L K-1. mol-1
78. Los términos hipotónicos e hipertónicos hacen referencia a disoluciones con menor o mayor presión osmótica que otra que se mantiene separada por una membrana semipermeable. En cambio isotónica es la que tiene igual presión osmótica. Así las cerezas que vemos a veces en las tiendas, grandes y brillantes, pueden ser un engaño. Lo que ocurre es que se han mantenido en agua, produciéndose el paso de ésta a través de la piel hacia su interior. Tan pronto se mantienen un tiempo fuera, en ambiente seco, el agua se evapora, y la cereza disminuye su volumen y se arruga. Dirás en este caso que los líquidos dentro de la cereza son respecto al agua:
a) Isotónicos b) Hipotónicos
c) Hipertónicos
d) Nada de lo dicho
79.Los glóbulos rojos pueden estallar en la sangre, produciéndose hemólisis si se inyecta suero que no sea isotónico con ellos, para eso debes saber que si la concentración de solutos en la sangre es aproximadamente del 0,3m, para que sea isotónico con la presión osmótica de los glóbulos rojos a la temperatura corporal normal de 37ºC, la presión osmótica del suero será aproximadamente en atmósferas de :
a) 8
b) 7 c) 7,6 d) 6, 5 e) Ninguno de los valores dados
DATOS: R= 0,082 atm.L K-1. mol-1
80. Dos disoluciones isotónicas deberán tener la misma o el mismo:
a) Tensión
superficial b) Densidad
c) Presión osmótica
d) Grado de disociación e) Punto de congelación f) Punto de ebullición
81.Van’t Hoff y Einstein, ambos científicos muy conocidos. El primero por su teoría del carbono tetraédrico, y el segundo por su teoría de la relatividad. Sin embargo recibieron el Nobel por trabajos que prácticamente son desconocidos para la mayoría de los estudiantes. El primero, y primer Nobel de Química, por sus trabajos sobre la presión osmótica, y el segundo por la explicación e interpretación del efecto fotoeléctrico. En el caso de Van’t Hoff su ecuación , tuvo que ser modificada para disoluciones de electrolitos introduciendo en ella Arrhenius, el factor i que llamó de Van’t Hoff que dependía del grado de disociación del electrolito, de manera que si se dispone de una disolución de concentración 30g/L de un soluto no iónico de masa molar 90g.mol-1, que es isotónica de una disolución de sulfato de hierro (III), que contiene 20g de soluto en 600mL de disolución, a la misma temperatura de 27ºC, dirás que:
a) El factor de van’t Hoff, del primer compuesto es 1
b) El grado de disociación del segundo es 0,75
c) La presión osmótica del sulfato férrico es aproximadamente de 7 atm
d) La presión osmótica de la disolución no disociada es menor
82. La ósmosis inversa fue propuesta por Reid, en 1953, para obtener agua desalinizada del mar. Consistía en provocar que el soluto saliera de la disolución por la acción de una presión muy superior a la osmótica. Si una disolución de sal marina tiene 10 g de sal común por litro de disolución y un grado de disociación del 90%, y la presión para provocar la ósmosis inversa es el triple de la osmótica, dirás que a 27ºC, tendrás que efectuar una presión aproximada en atmósferas de :
a) 24
b) 15 c) 8 d) 10 e) Ninguno de los
valores dados
Masa molar del
cloruro sódico = 58,5 g mol-1. R= 0,082 atm.L K-1. mol-1
83. Desde hace muchos siglos, la conservación de los alimentos se hacía introduciéndolos en grandes arcones con sal. De ahí derivó la producción de jamones, lacones, cecinas y demás carnes saladas. Ello era debido a que las bacterias necesitaban agua en las células para su proliferación, y ésta desaparecía por un fenómeno de :
a) Desalinización b) Salinización c) Ósmosis inversa
d) Ósmosis
84. Cuando tomas algo muy salado, tienes la necesidad de beber, provocándose la retención de líquidos y aumentando tu masa. Ello es debido a que el agua pasa al interior de las células con mayor concentración salina. Este hecho se debe a un fenómeno de :
a) Mayor presión de vapor b) Mayor molaridad c) Ebulloscopía
d) Ósmosis
e) Mayor presión osmótica
Si la presión osmótica de una disolución acuosa de glucosa es 2 atm, la de otra de sal común disociada al 90%, con la misma concentración e a igual temperatura, deberá ser en atmósferas de :
a) 2
b) 1,45 c) 4 d) 3,8 e) Nada de lo dicho
86. Los árboles necesitan subir la savia por el xilema hasta las hojas verdes para producir la función clorofílica, en contra de la acción de la gravedad. Para ello necesitan una fuerza impulsora muy grande, sobre todo si son muy altos, lo cual impide que otras plantas en sus inmediaciones puedan recibir por sus raíces las sustancias nutritivas disueltas. Esta fuerza impulsora se debe en su mayor parte a un fenómeno de :
a) Acción antigravitatoria b) Atracción del sol c) Ósmosis
d) Ósmosis inversa
d) Nada de lo dicho
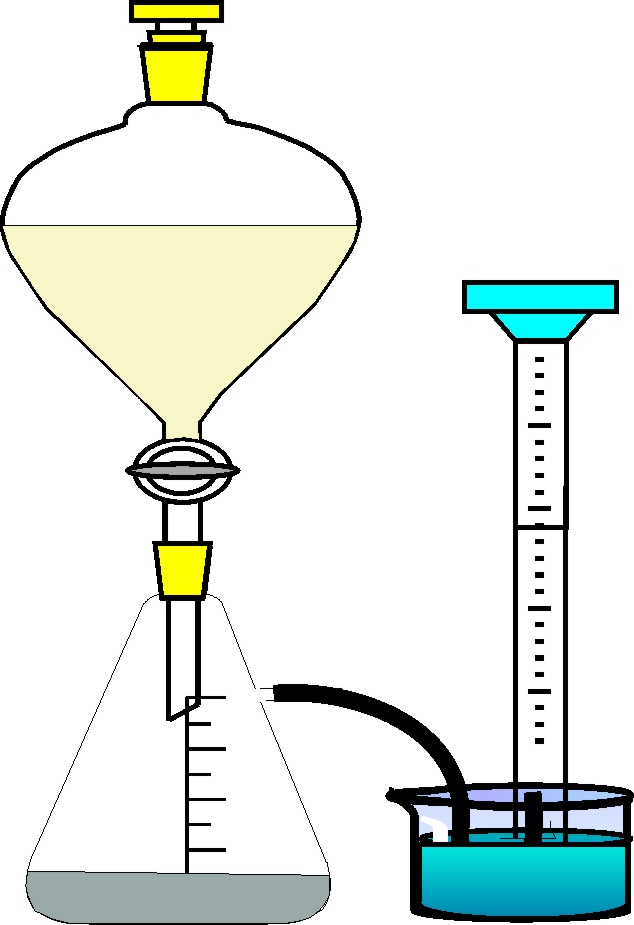
87*.Aunque fue el primero en aislar el bacilo del tétanos y la peste bubónica, el biólogo japonés Kitasato, es mas conocido por el recipiente de vidrio, de fondo plano y con un tubo de salida lateral que lleva su nombre. Si es un recipiente como ese, sitúas granallas de cinc en exceso y en el embudo de decantación A, 50 cm3 de ácido sulfúrico, al abrir la llave E, y reaccionar las granallas con el ácido, se producen 50 mL de un gas insoluble en el agua que se recogen en una probeta invertida a 1 atm y 20ºC, si no tienes en cuenta la presión del vapor de agua a esa temperatura, podrás asegurar que si el rendimiento de la reacción es del 100%, la disolución de ácido sulfúrico, cuyo grado de disociación medio es del 60%:
a) Es 0,08N b) Es
0,04 m
c) Tiene un factor de van’t Hoff igual a 3
d)Tiene una presión osmótica a 20ºC de 3 atm.
e) Congela a -0,17º
MASAS ATÓMICAS: S,32- H,1-O,16.
Kc MOLAR=1,86 KKg/mol R=0,082 atmLK-1mol-1
88*.El ácido triclororacético,
fue descubierto por el francés Dumas, cuando demostró su teoría de la sustitución,
al tratar ácido acético(etanoico) con clorhídrico, y también determinó su peso molecular empleando
el método de las densidades de vapor; éste era de 164. Si se prepara una disolución
acuosa al 5%, siendo su grado de disociación del 60%, dirás que :
a) Su factor de Van’t Hoff es 1,6
b) La molalidad de la disolución formada es 0,32
c) El incremento ebulloscópico es 1ºC
d) Su presión osmótica a 17ºC es aproximadamente de 12 atm.
e)La disolución formada congela aproximadamente a -1ºC
DATOS: Kcrioscópica(H2O)=1,86 KKg/mol;
Kebulloscópica(H2O)=0,52 KKg/mol ;
R=0,082 atmLK-1mol-1
89.El ácido salicílico (orto hidroxibenzoico), base de la aspirina y de otros muchos medicamentos actuales, fue sintetizado por primera vez en 1850, por el alemán Kolbe, y en principio se empleó como desinfectante y germicida. Es un ácido monoprótido de grado de disociación 0,06. Si disuelves 5 gra-mos del mismo en 100 ml de agua, a 17ºC, dirás que a:
a) Su factor de Van’t Hoff es casi 1
b) La molalidad de la disolución formada es 0,35
c) El incremento ebulloscópico es 0,2K
d) Su presión osmótica a dicha temperatura es 10 atm
e) La disolución formada congela a -1ºC
DATOS: Kcrioscópica(H2O)=1,86 KKg/mol;
Kebulloscópica(H2O)=0,52 KKg/mol ;
Masa molar 138gmol-1; R=0,082
atmLK-1mol-1
90.Se preparan 3 disoluciones acuosas muy diluidas de la misma molaridad, una de ácido clorhídrico, otra de ácido acético y la tercera de glucosa, manteniéndose las mismas condiciones de temperatura. De estas disoluciones podrás asegurar que :
a)
La de glucosa tendrá mayor presión osmótica
b)
La de ácido clorhídrico tendrá el punto
de congelación mas bajo
c)
La de ácido acético tendrá el punto de ebullición
más alto