GRUPO HEUREMA. EDUCACIÓN SECUNDARIA
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
TEST DE QUÍMICA CON ENUNCIADOS FORMATIVOS
DISOLUCIONES 2 (continuación)
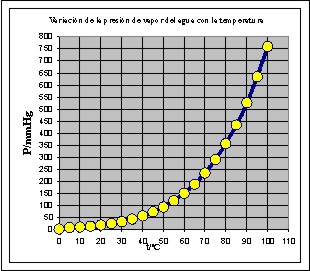
25*.La presión de vapor, es la tendencia o presión que ejercen las moléculas de un líquido, contra la de los componentes del aire que están en su superficie libre. Cuando se encuentran en equilibrio físico en los dos estados, esta presión sólo depende de la energía cinética de las moléculas del líquido y por lo tanto de su temperatura, por eso cuando varía ésta, también lo hace aquella. Por eso un líquido hierve cuando su presión de vapor es igual a la presión atmosférica. Si se observa la gráfica de variación de la presión de vapor del agua, con la temperatura se podrá asegurar que:
a) Sólo al nivel del mar el agua hierve a 100ºC
b) La presión de vapor del agua a 50ºC, es
la mitad que a 100ºC
c) Al disminuir la temperatura, la presión
de vapor del agua disminuye
d) Al aumentar la temperatura por encima de
los 100º, el agua sólo se mantendrá en estado líquido si la presión es superior
a la normal.
e) A la derecha de la curva, el estado físico
del agua es líquido
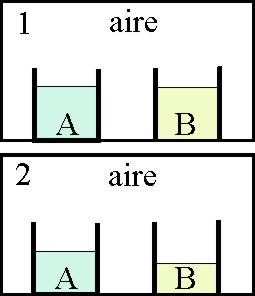
26. Dos líquidos A y B, se encuentran en los recipientes abiertos e iguales del dibujo, dentro de un recinto cerrado, y en la situación 1. Al cabo de cierto tiempo se alcanza la 2, y el estado de los líquidos es el reflejado. La observación del dibujo te permitirá asegurar que:
a) La presión de vapor de A es mayor que la
de B.
b)La presión de vapor de A es menor que la de B
c)La presión de vapor de A es igual a la de B
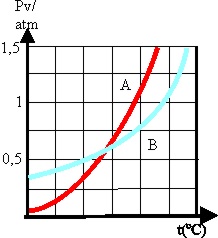
27. Dadas las curvas de variación de la presión de vapor con la temperatura de dos sustancias A y B, se podrá asegurar que:
a) A presiones externas muy bajas la tempertura de ebullición
de B es menor que el de A
b) A presión atmosférica hervirá antes B que
A
c) La
tendencia a evaporarse será mayor en B
que en A, a media atmósfera.
d) Ambos hervirán a la misma temperatura a
una determinada presión.
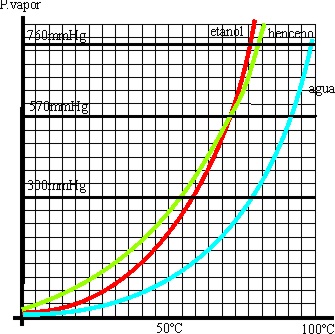
28*. Van’t Hoff, estaba fuera de los círculos mas representativos en la Química del XIX, pues daba clase en una escuela veterinaria de Utrech, en Holanda. Sin embargo, llegó a ser el primer premio Nóbel de Química. Aunque Dalton en 1804, hizo las primeras gráficas de variación de presión de vapor con la temperatura, se le atribuye a Van’t Hoff su divulgación. Si te dan las curvas de 3 conocidos disolventes: agua, benceno y etanol, dirás que:
a) El etanol hierve antes en condiciones
normales
b) El benceno es el líquido que
hierve antes en todas las condiciones
c) El agua es el líquido que hierve a mayor temperatura en todas las condiciones
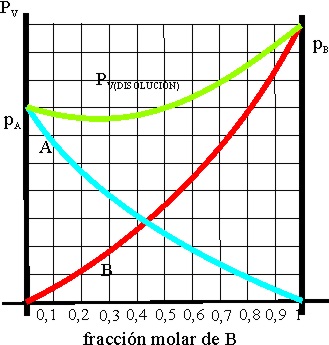
d) El benceno y el etanol pueden hervir a la misma temperatura
29. Si te dicen que las presiones de vapor de 3 disolventes A, B y C, a 50ºC, son 0,5; 1 y 1,5 atm, respectivamente, podrás asegurar que en condiciones normales:
a) Los tres estarán siempre en estado gaseoso
b) Sólo el A estará en estado gaseoso
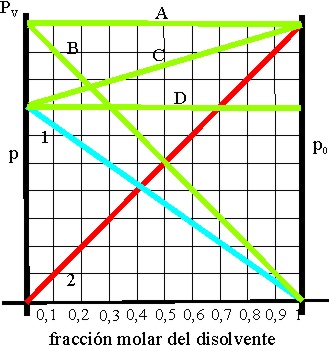
c) Sólo en C estará en estado líquido
d) Sólo el B estará en estado líquido
30.Se deberá tener en cuenta la presión del vapor de agua, siempre que un gas se recoja sobre ella. Así cuando se obtiene oxígeno en la descomposición térmica del permanganato potásico, y se recoge como se observa en la foto, sobre agua, en una probeta invertida. El oxígeno desprendido desplaza al agua, y aparece en su parte superior. Si se conoce el volumen de gas, y la temperatura externa, para determinar el número de moles, se precisa saber la presión que ejerce el oxígeno, dado que la presión externa(atmosférica) Patm, equilibra la presión que ejerce una columna de agua de altura H (pH), la presión del oxígeno PO2, y la presión del vapor PVH2O de agua. Por eso la presión del gas será:
a) Patm+PVH2O +PH
b) Patm-PVH2O -PH
c) Patm+PVH2O -PH
d) Patm-PVH2O +PH
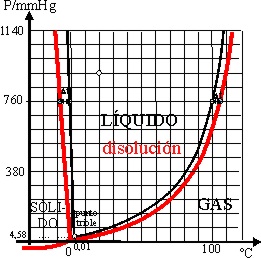
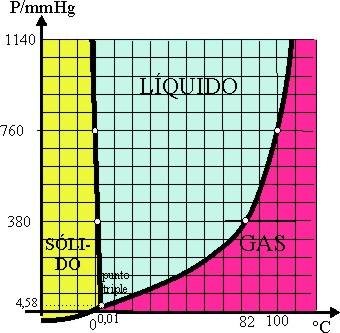
31*.Las gráficas de las variaciones de la presión de vapor se generalizaron para los diferentes estados del mismo compuesto, dando lugar a los diagramas de fases, que determinan las fronteras de existencia de un compuesto en sus diferentes fases o estados físicos, llamándose punto triple aquél en el que coexisten los 3 estados en equilibrio para un mismo compuesto. Visto el del agua, podrás asegurar que:
a)Manteniendo la temperatura constante, el agua podría hervir
a 82ºC, si la presión atmosférica se reduce a la mitad.
b)Si la presión es muy grande, el agua solidificaría
a temperatura inferior a los 0ºC
c)El vapor de agua condensaría , a menos de 100º
si la presión disminuye.
d)Por debajo del punto triple el hielo puede sublimar


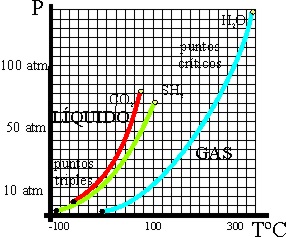
32*. Andrews en 1863, llamó punto crítico a aquellas coordenadas Pvapor/ temperatura, a partir de las cuales un gas no podía licuar, o sea el punto final de la frontera interfase gas –líquido para un compuesto, indicando que “ a esa temperatura la superficie de separación entre líquido y gas se vuelve indistinta y finalmente desaparece”. Si te dan una tabla de puntos triples y puntos críticos para 3 sustancias como CO2, H2O y SH2,
| |
Punto triple |
Punto crítico |
||
| Sustancia |
P.vapor/mmHg |
T/ºC |
P.vapor/mmHg |
T/ºC |
| Dióxido de carbono |
3580 |
-56,4 |
55125 |
31,14 |
| Agua |
4,58 |
0,01 |
165000 |
374 |
| Sulfuro de hidrógeno |
170,25 |
-85,4 |
67050 |
100 |
podrás asegurar
que:
a)
La sustancia que puede sublimar a presión atmosférica es el dióxido de carbono
b)
La sustancia con condiciones críticas mas extremas
es el agua
c)
El sulfuro de hidrógeno , por encima de los
100º nunca se convertirá en líquido
d)
En las condiciones en las que el sulfuro de
hidrógeno es siempre sólido, el dióxido de carbono es gas
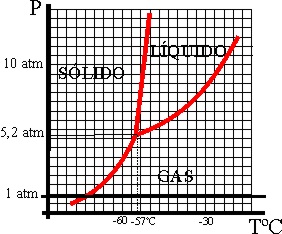
33*.En test anteriores, se ha presentado el diagrama de fases del agua. Aunque es el líquido mas común, su diagrama de fases es anómalo, porque debido a sus enlaces por hidrógeno, también lo es en su comportamiento. Lo normal es que las pendientes de las interfases sean siempre positivas, tal como ocurre con el diagrama de fases del dióxido de carbono que se da. De este diagrama de fases se puede sacar en conclusión que el dióxido de carbono:
a) Sólo sublima a por debajo de los -57ºC
b) Sólo sublima a presiones altas
c)
Nunca puede estar en estado líquido a presión atmosférica
d)
Nunca puede estar en estado líquido a 0ºC
34*.Dadas las gráficas de la variación de la presión de vapor desde la temperatura del punto triple hasta la del punto crítico, para el dióxido de carbono, sulfuro de hidrógeno y agua, podrás asegurar que :
a) El compuesto más difícil de licuar en cualquier
condición es el dióxido de carbono
b) El compuesto más estable en estado líquido
es el agua
c) A la temperatura a partir de la cual el
dióxido de carbono es gas sea cual sea la presión, el sulfuro de hidrógeno
puede ser líquido
d) El dióxido de carbono es el gas más difícil
de solidificar
35.Von Babo en 1847, encontró que al agregar una sal al agua, tenía lugar un descenso relativo en la presión de vapor de la disolución, respecto a la del disolvente puro, que siempre se mantenía constante a cualquier temperatura, sin embargo no fue capaz de encontrar una relación para dicha constante. Wüllner en 1856, determinó que dicha constante era una expresión de la concentración que ahora sabes se refiere a la:
a) molaridad
b) molalidad c)fracción
molar d) normalidad
36. Cuando se agrega un soluto no volátil a un disolvente, la presión de vapor de la disolución se modifica respecto a la del disolvente puro. A la izquierda vemos las curvas de variación de la presión de vapor del disolvente d, y la de la disolución D a distintas temperaturas.
Según las gráficas dadas, se podrá asegurar que:
a) El intervalo de temperaturas en que se
encuentra en estado líquido el disolvente será mayor
b) El intervalo de temperaturas en que se
encuentra en estado líquido la disolución será mayor
c) La presión de vapor de la disolución es
mayor que la del disolvente
d) El punto de ebullición a la presión atmosférica
de la disolución será menor
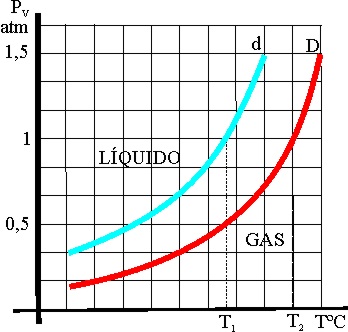
37*.En 1887, Raoult confirmó los trabajos previos de Babo y Wüllner, sobre modificación de la presión de vapor del disolvente al disolver un soluto, y estableció que el descenso relativo de aquella, era igual a la fracción molar, o sea que la constante de la concentración que tanto buscaron sus predecesores, era nada menos que la fracción molar del soluto, magnitud independiente de la temperatura. Esta será la ley de Raoult, que traerá consecuencias ligadas a aquellas propiedades que dependen de la presión de vapor, referidas a la disolución como:
a) Disminución del punto de ebullición b) Aumento del punto de congelación
c) Aumento de la solubilidad d) Aumento del punto de ebullición
e) Disminución del punto de congelación
38*.Raoult, leyó su tesis doctoral, sobre la fuerza electromotriz en celdas voltaicas en 1863, y cuatro años después fue nombrado profesor en la universidad de Grenoble. En 1875, en una investigación sobre bebidas alcohólicas deduce experimentalmente que existe una relación lineal entre su contenido en alcohol y su punto de congelación. Este fue el punto de partida de lo que después sería llamado ley de Raoult, aplicada especialmente a solutos no volátiles y en concentraciones diluidas, y lo que indica es que.
a) El descenso de la presión de vapor de la
disolución es directamente proporcional a la fracción molar del disolvente.
b) La presión de vapor de la disolución es
igual a la fracción molar del soluto por la presión de vapor del soluto
c) La presión de vapor de la disolución es
igual a la fracción molar del disolvente por su presión de vapor
d) La variación relativa de la presión de valor
de la disolución es directamente proporcional a la fracción molar del soluto
39.La ley de Raoult hace referencia a la presión de vapor del disolvente, ya que, al ser el soluto no volátil su presión de vapor es prácticamente despreciable. Sin embargo la ley de Henry, propuesta en 1803, y por lo tanto 27 años antes de nacer Francisco María Raoult, ya establecía la proporcionalidad entre la presión de vapor del soluto (volátil) y su fracción molar, por eso se complementan, considerándose ideales las disoluciones que cumplen ambas. Sin embargo, la primera, también se puede poner en función de la fracción molar del soluto y ello es debido a que:
a) La
suma de las fracciones molares de soluto y disolvente es 1
b) La
disoluciones son diluidas y prácticamente la fracción molar del soluto es
despreciable frente al disolvente
c) La presión de vapor de la disolución se
debe fundamental a la presión de vapor del disolvente
d) Todo lo dicho anteriormente
40.Si tanto el soluto como el disolvente son volátiles, también debe cumplirse la ley de Raoult, de forma que la presión de vapor de la mezcla sea la suma de la presiones de vapor de ambos, y a su vez es igual a la cada uno por separado por su fracción molar o sea de la proporción en que se encuentren. Así si te dan la gráfica de la figura con las presiones de vapor de dos sustancias 1 y 2 que forman una disolución ideal dirás que la línea que mejor representa la presión de vapor de la mezcla será la :
a) A b) B
c) C d) D
e) Ninguna de las dadas
41.Las disoluciones que cumplen la ley anterior se denomi-nan ideales, y eso supone que no hay interacción entre soluto y disolvente, porque en el caso de dos disolventes volátiles A y B, si la interacción entre las moléculas A-A y B-B, es menor que la que se produce entre A y B, entonces la presión total y las individuales vendrían dadas por la gráfica dada dado que las tres presiones de A, B y A+B serán:
a) Mayores
que las que predicen las leyes de Raoult
b) Menores que las que predicen las leyes de
Raoult
c) Iguales que las que predicen las leyes de
Raoult
d) No
se puede predecir
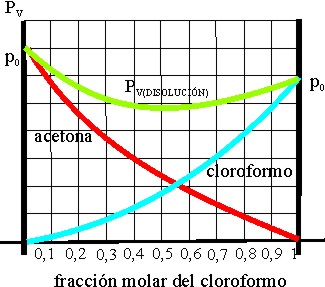
42*. Se dispone de una mezcla de cloroformo CHCl3 y acetona CH3-CO-CH3, y la gráfica que nos da la presión de vapor de cada uno, y de la mezcla resultante es la dada, según ello podrás afirmar que:
a) Ninguno cumple la ley de Raoult
b) Las moléculas de ambos disolventes son dipolares
e interaccionan entre sí
c) La presión de vapor de la disolución es
la suma de la ambas sustancias
d) La interacción entre el cloroformo y la
acetona es menor que la que se produce entre las moléculas de cloroformo,
y entre las moléculas de acetona
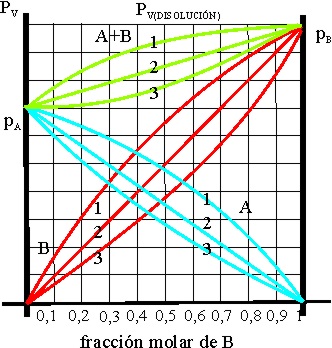
43.En el caso de una disolución formada por dos componentes volátiles A, y B, si la interacción entre A y A, y B con B, es mayor que la que se produciría entre A y B, la tendencia a escapar como vapor de cada especie aumenta, porque cada molécula A rechaza a B, y viceversa, obligándola a pasar a fase vapor , por eso en este caso, la gráfica correcta para la variación de las presiones de vapor de A, B y A+B, será de todas las dadas la:
a) 1
b) 2 c) 3
d) Ninguna de las dadas
44. Las consecuencias de la disminución de la presión de vapor de la disolución respecto a la del disolvente, cuando el soluto no es volátil son :
a) Que se hace más soluble
b) Que se hace más volátil
c) Que congela a menor temperatura
d) Que hierve a menor temperatura
45*.En la figura se observa cómo se modifica el diagrama de fases del agua, cuando se le agrega un soluto no volátil. Su observación te permite asegurar que:
a) La formación de hielo será mas difícil con agua salada que con agua
dulce
b) La fase líquida aumenta sus
temperaturas límite para una misma presión
c) La variación del punto de congelación es menor que la del punto de
ebullición
d) Es más fácil hervir el agua salada que el agua dulce
46*. Cuando sobre agua destilada echas un poco de azúcar dirás que la disolución formada:
a) Tiene mayor presión de vapor que el agua
pura a la misma temperatura
b) Hierve a mayor temperatura
c) Congela a mayor temperatura
d) Se comporta siguiendo las leyes de Raoult
e) Se comporta como si fuera agua pura
47.En 1771, Watson, observó que el tiempo que tardaba en congelar una disolución salina, era proporcional a su concentración. Blagden,17 años después, establece una ley de proporcionalidad entre el descenso del punto de congelación y la concentración de la disolución, ley conocida como de Blagden. Coppet, en 1871, estableció que cantidades equimoleculares de soluto agregadas a la misma cantidad de disolvente, producen el mismo descenso en el punto de congelación, sin embargo incurrió en el error al creer que éste era proporcional al “peso atómico” del soluto. Todos estos trabajos precedieron a los conocidos de Raoult. Observando las curvas de interfase S-L, para diferentes concentraciones, se puede establecer una relación entre los descensos de la presión de vapor y los descensos de la temperatura de congelación, con lo que éstos que deberían ser proporcionales a la fracción molar del soluto. Sin embargo para disoluciones diluidas, se puede considerar despreciable los moles de soluto, con lo que la proporcionalidad se hace entre el descenso del punto de congelación y la:
a) la
fracción molar b)
molaridad c) molalidad d) solubilidad
48. Las modificaciones de la presión de vapor, punto de ebullición, punto de congelación de un disolvente cuando se le agrega un soluto no volátil formando una disolución diluida, se enmarca dentro de las propiedades coligativas de estas, nombre derivado del latín colligatus (estrechamente relacionado). Estas propiedades tienen de común que para cada disolvente dependen sólo de :
a) El número de partículas de soluto
b) La naturaleza del disolvente
c) La temperatura
d) El número de partículas de soluto y de su naturaleza
e) La solubilidad del soluto
49*. La constante crioscópica molal del agua es 1,86 K.kg/mol esto quiere decir que:
a) Cualquier soluto no volátil en concentración
1m, congela a -1,86ºC
b) Se formaría hielo a -1,86ºC
c) Cualquier disolución acuosa en concentración 1m congela a -1,86ºC
d) El agua se separaría del soluto en una disolución
1m, a -1,86ºC
e) Nada de lo dicho