ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
TEST
DE QUÍMICA CON ENUNCIADOS FORMATIVOS
DISOLUCIONES I
1*.Parece ser que Tomás de Aquino, fue el primero en obtener el ácido sulfúrico con el nombre de óleo de vitriolo, líquido oleoso conseguido a partir bonitos cristales, de ahí su nombre, aunque posiblemente se hubiera aprovechado de traducir los trabajos del árabe Geber. Si echas ácido sulfúrico concentrado sobre agua para preparar una disolución de aquél, observarás que el matraz donde realizas la operación se calienta bastante. Esto te llevará a decir que:
a) Se ha desprendido calor de disolución
b) El ácido sulfúrico tiene mucha energía de hidratación
c) El ácido sulfúrico tiene mucha afinidad por el agua
d) Posiblemente se forme un hidrato
e) Se establecen enlaces de hidrógeno

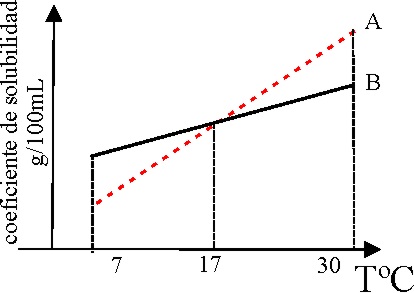
2*.En 1819, el francés Gay-Lussac, escribe su “Primera memoria sobre la disolución de las sales en el agua”. En ella aparecen por primera vez las curvas de la variación de la solubilidad con la temperatura para diversas sustancias. La gráfica que te dan hace referencia a la variación de la solubilidad con la temperatura de dos sustancias A y B. De su observación y análisis podrás decir que:
a) La A es mucho más soluble en la caliente que la B
b) Si tenemos una disolución saturada de ambas a 17ºC y enfriamos en el
fondo del recipiente se separará A.
c) Si tenemos una disolución saturada de ambas a 17ºC y enfriamos en el
fondo del recipiente se separará B
d) Será más fácil de cristalizar A que B.
e) Será más fácil preparar una disolución sobresaturada con la B que con
la A
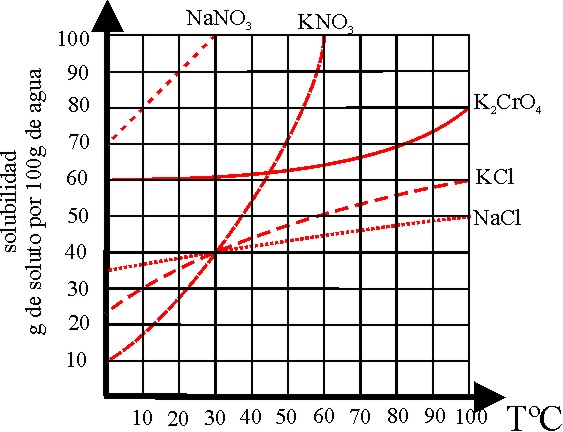
3*.Hasta el siglo XVIII, la mayoría de las reacciones se realizaban en fase sólida. Fue el sueco Tobern Bergman, el que en 1778, escribe “De analysi aquarum”, y dos años mas tarde.”De minerarum docimasia humida”, el que comienza la química en disolución, y por lo tanto estudia la solubilidad en el agua empleada como disolvente. Si observas con detenimiento la gráfica de la figura podrás decir que:
a) El menos soluble a 10ºC es el nitrato potásico
b) En 100g de disolución saturada a 20ºC hay más cantidad de agua si el
soluto es nitrato sódico
c) La menor cantidad de agua para disolver 40g de sal común a 30ºC es
de 60g
d) La disolución mas concentrada a 40ºC será la de nitrato sódico
e) La disolución que menos varía su solubilidad con la temperatura es
la de cloruro sódico
4.Si echas un poco de azúcar sobre el café con leche y agitas con la cucharilla observas que se disuelve mejor, en cambio si agitas una botella con un refresco gaseado, salta el tapón. Esto va a indicar que la solubilidad de los gases en el agua:
a) Aumenta con la agitación
b) Es menor si la temperatura aumenta
c) Disminuirá al enfriar
d) Se favorece al suministrarse energía a su sistema
e) Es invariable.
5.En el libro verde de la IUPAC (no confundir con el libro verde del líder libio Gadaffi), se define la relación entre cantidad de sustancia o cantidad química en moles de soluto y el volumen de la disolución, sin embargo la Comisión de Símbolos, terminología y unidades de la IUPAC, enfatiza en 1979, que esta relación hace referencia a la “cantidad de concentración de una sustancia”. Esta cantidad, se describe con el adjetivo molar, representándose por una M. Si tomas con una pipeta 1 mL de ácido sulfúrico del 98% y densidad 1,86g/cm3, y con mucho cuidado lo diluyes enrasando el matraz aforado hasta 100mL, podrás asegurar que su molaridad es en moles/L aproximadamente:
a) 0, 1 b) 0,2 c) 0,3 d) 0,4 e)
Nada de lo dicho
Masa molar del ácido sulfúrico
=98gmol-1
6.La definición de molaridad indica que no es una unidad del SI, dado que en este sistema el volumen se mide en m3. Por eso Gillespie en 1960, había definido el molón, con símbolo w, esto es la relación entre los moles de soluto y el kilogramo de disolución. Por lo tanto una medida de la concentración en el sistema internacional, sin tener en cuenta la propuesta del científico canadiense, debería darse en mol/m3, que sería igual en magnitud que 1mmol/L=1: mol/cm3 = 1: mol/mL. Así si tienes una disolución 5M, en el SI, dirás que equivaldría a:
a) 50 mol.m-3 b) 500 mol.m-3 c) 5000 mol.m-3
d) 5 mol.m-3 e)
Nada de lo dicho
7. Aunque posiblemente no lo creas, el concepto de normalidad es anterior al de molaridad, pues desde hace mucho tiempo los químicos quisieron establecer una relación entre la masa de soluto y el volumen de la disolución, pero el término de mol no se generalizó hasta después de 1900, mientras que el de equivalente lo hizo mucho tiempo antes. Pese a ello suele aprenderse a hacer problemas de molaridad antes que los de normalidad. Si se hacen burbujear 2L de dióxido de azufre, gas a 27ºC y 700mmHg de presión, sobre 3 litros de agua. sin exista aumento aparente de volumen.
Dirás que la molaridad de la disolución
es aproximadamente en mol.L-1:
a)0,025 b)
0,25 c) 0,0025 d)2,5 e) Nada de lo dicho
R= 0,082 atm.L. K-1
mol-1
8. El equivalente gramo de un elemento químico, son los gramos del mismo que :
a) Capaces de dar o recibir un mol de electrones
b) Contienen el número de Avogadro de átomos
c) Reaccionan con 12 g de carbono
d) Son capaces de producir 22,4 litros de hidrógeno
e) Se combinan con 16 g de oxígeno
9. Suele definirse la normalidad como el nº de equivalentes gramo del soluto por litro de disolución. Pero el concepto de equivalente gramo fue muy difícil de definir, y causó graves problemas durante el siglo XIX, para determinar el comportamiento de una sustancia, porque precisamente dependía de él, y del tipo de reacción en el que se viera implicado. Pese a ello suele decirse que la normalidad es igual a la molaridad por la valencia, que en este caso no se trata de la de un determinado elemento químico sino de la del compuesto, por eso si la molaridad de una disolución de carbonato férrico producido en una neutralización es 1, dirás que su normalidad es :
a) 2 b) 3 c) 4
d) 5
e) 6
10. En 1828, Gay Lussac, publica un trabajo sobre:”Essai des potasses du comerce”. En él no sólo se describe por primera vez, el vaso de precipitados graduado (cuatro años antes, había usado por primera vez los términos pipeta y bureta, como instrumental de laboratorio; la bureta se conocía mucho antes pero con otro nombre), sino que emplea por primera vez el término “acide normale”, aplicándolo a una solución estándar de 100 gramos de ácido sulfúrico diluido hasta un litro. Actualmente esto sería erróneo, ya que la normalidad de este ácido sulfúrico sería:
a) 1,20 b) 2,04 c) 3,03 d) 1 e)
Nada de lo dicho
Masa molar del ácido sulfúrico 98g/mol
11. La nomenclatura inorgánica clásica ha cambiado bastante, al estudiar el comportamiento de los compuestos químicos, así el ácido ortofosforoso, se comportaba de una manera extraña, ya que solo disociaba o sustituía 2 de sus tres hidrógenos. Ello motivó que sea llamado actualmente ácido fosfónico. Si dispones de 300mL de disolución 0,1N de ácido ortofosforoso, sabrás que en ella hay:
a) 0,1 equivalentes gramo de ácido
b) 0,1 moles de ácido
c) 0,66.1023 moléculas de ácido
d) 8.1022 átomos de fósforo
e) Menos de 1023 átomos de oxígeno
nº Avogadro:6,0.1023mol-1
12.El nombre comercial del hidróxido sódico es sosa al que se le suele agregar el adjetivo de cáustica, porque quema las mucosas y la piel, y en los textos se lee que su origen está en soda inglés, del cual derivará el nombre del sodio. Nada mas lejano de la realidad, ya que el soda inglés deriva como el sosa hispano, del árabe sauda que llevaban plantas de las marismas, por eso en España existen muchos topónimos e hidrónimos sosa. Si queremos obtener una disolución 0,1N de hidróxido sódico partiendo de 10 mL de otra al 40%, con densidad 1,2gmL-1, suponiendo los volúmenes aditivos tendemos que agregarle un volumen de agua destilada en mL de
a)40 b) 190 c)1190 d)1490 e) 1990
Masa molar del hidróxido sódico=40gmol-1
13. Los ortofosfatos mejor llamados fosfatos, por ser los más normales, son un componente importante del organismo humano, no sólo en los tejidos de sostén (huesos), sino en la sangre como regulador del pH, y en los músculos, aportando energía, no es de extrañar por eso que el fósforo se haya descubierto en la orina humana. Pues bien, mezclando 50 mL de disolución al 40% de ácido ortofosfórico de densidad 1,3g/cm3 con 200 mL de disolución 1M del mismo ácido obtendrás, si supones que los volúmenes son aditivos, una disolución cuya normalidad será aproximadamente en equivalentesL-1:
a)5,58 b) 0,56 c) 6,12 d)
2,93 e) Nada de lo dicho
Masa molar del ácido ortofosfórico 98gmol-1
14.El concepto de normalidad fue
creado por Mohr, en 1855, en un tratado sobre métodos de valoración en química
analítica (texto que se estuvo reeditando durante más de 60 años), y es uno
de los más empleados en la valoración de una disolución de un reactivo químico.
Si se dispone de 20 ml de ácido tetraoxoclórico(VII), cuya densidad
es de 1,4 g/cm3, y de una
cantidad suficiente de cloruro de hierro(III) sólido. Si al reaccionar se producen 100ml de gas a 700mmHg de presión
y 15ºC, con un rendimiento del 80% , dirás que normalidad de la disolución
del ácido dado en equivalentes/L, será aproximadamente:
a) 0,014 b) 0,024 c) 0,14 d) 0,24 e)
Nada de lo dicho
15.La fracción molar al ser una medida relativa de la concentración, independiente de la temperatura, fue fundamental a principios del siglo XX, para establecer la medida de las modificaciones que experimentaban los disolventes cuando se agregaba un soluto. No tiene unidades, pues relaciona los moles de soluto con los moles totales existentes en la disolución, y sólo vale 1 cuando no existe disolvente. Si haces burbujear 2 litros de dióxido de azufre a 27ºC y 700mmHg de presión, sobre 4 litros de agua, dirás que la fracción molar del soluto es aproximadamente
a) 0,0034 b) 0,00034 c) 0,034 d)0,34 e) Nada de lo dicho
R=0,082 atm.L. K-1 mol-1
16.La fracción molar se representa
por la letra x, sólo en disoluciones y fases condensadas, dado que la IUPAC,
recomienda en su libro verde que se emplee la letra y, en las fases gaseosas.
Si se mezclan 200ml de ácido sulfuroso 1M con la disolución formada al burbujear
0,6.1023 moléculas de dióxido de azufre sobre 200ml de agua, suponiendo
los volúmenes aditivos dirás que la fracción molar de la disolución resultante cuya densidad es 1,2g/cm3
será aproximadamente:
a) 0,012 b) 0,0012
c) 0,00012 d)
0,12 e) Nada de lo dicho
nº de Avogadro
=6,0.1023mol-1. Pesos atómicos: S=32, O=16, H=1
17. La molalidad comienza a emplearse mucho mas tarde que la molaridad, junto con los términos peso molal, volumen molal, a comienzos del siglo XX, a través de los trabajos de Lewis, el que también había bautizado a los cuantos de luz como fotones. La molalidad es la relación entre los moles de soluto respecto a la masa en kilogramos del disolvente, y por lo tanto sus unidades pertenecen al SI, a diferencia de la molaridad, y al depender de la masa que es una magnitud constante, no depende de la temperatura. Sin embargo dado que muchas veces al preparar una disolución mides su volumen, es necesario conocer la densidad de la misma para calcular su molalidad. Así si se mezclan 50cm3 de disolución de ácido ortofosfórico 1M, con 150cm3 de disolución 2N del mismo ácido y se obtiene una disolución de densidad 1,2g/ml, dirás que, suponiendo los volúmenes aditivos, su molalidad en moles/kg es aproximadamente:
a) 0,57 b) 0,45 c) 0,67 d)
1,65 e) Nada de lo dicho
18. En el libro verde se define la molalidad (m) de un soluto A en un disolvente B, como nA/kgB, sin embargo posteriormente y en nota a pie de página se advierte que la letra m que la representa, es susceptible de indicar otras muchas magnitudes como momento magnético, momento angular, masa etc, por lo que recomienda que se emplee la b minúscula, recomendación que nadie ha hecho caso. Si haces burbujear 2 litros de dióxido de carbono a 17ºC y 700mmHg de presión, sobre 2 litros de agua, dirás que la molalidad de la disolución en moleskg-1 será aproximadamente:
a) 0,03 b ) 0,04 c) 0,05 d) 0,06 e)
Ninguno de los valores dados
mientras que su fracción molar
será aproximadamente:
a) 0,0004 b) 0,0005 c) 0,0006 d) 0,0007 e) Ninguno de los valores dados
R=0,082 atm.L. K-1 mol-1
19.La molaridad y la molalidad de una disolución son casi idénticas cuando está muy diluida, pues los gramos de soluto serían despreciables frente a los de disolvente, y la densidad de aquella se aproximaría a la del agua destilada. Sin embargo si conociendo la molaridad de una disolución nos pidieran que calculáramos la molalidad, tendrían que indicarnos:
a) La temperatura de la disolución
b) La riqueza de la disolución
c) La densidad de la disolución
d) El volumen y la masa de la
disolución
e) El % en peso de la disolución
20. Cuando preparas una disolución es muy importante conocer la concentración a fin de ponerle título a la misma, etiquetando el recipiente donde se guarda. El comienzo de la titulación, en el que se valoró el carbonato potásico de la ceniza, con un ácido, titulando a éste, fue en 1756, y lo hizo Francis Home. Existen muchas formas de expresar la concentración, algunas de ellas definidas oficialmente en el “Libro verde” de la IUPAC, cuyo origen se traslada a 1969, como la molaridad, la normalidad, la molalidad, la riqueza, los % en peso y volumen, la fracción molar, y los gramos de soluto en un volumen de disolución, sin embargo la titulación en química, por ser la medida mas antigua sólo hace referencia a:
a) La molaridad b)La fracción
molar c) El % en peso d) La normalidad
e) Los gramos de soluto en un volumen de disolución
21.Al preparar una disolución completando el volumen de la misma añadiendo agua destilada hasta enrasar el matraz aforado, observarás que hasta el nivel del aforo, hace referencia a la temperatura a la que se realiza la medida del volumen, dado que la mayoría de las formas de expresión de la concentración al depender del volumen lo hacen también de la temperatura, de todas las formas indicadas en la cuestión anterior, sólo son independientes de la temperatura:
a) La molalidad, la molaridad y la fracción molar
b) La molaridad, la normalidad y % en volumen
c) La fracción molar, el % en volumen y la molalidad
d) El % en peso, la molalidad y
la fracción molar
e) Nada de lo dicho
22.Aunque se conocía desde el siglo XV, el ácido clorhídrico no se denominaba así, ya que el cloro se descubrió mucho mas tarde. Su nombre primitivo era ácido de sal marina, ácido marino, y después ácido muriático, y en principio se creía que tenía oxígeno. Tuvo que luchar mucho el inglés Davy para convencer a los químicos de su tiempo (principios del XIX), de que sólo tenía hidrógeno. Si se mezclaran 50cm3 de disolución de ácido clorhídrico 1M, con 150ml de otra 4m del mismo ácido y con densidad 1,1g/ml, suponiendo los volúmenes aditivos, dirás que la normalidad de la disolución resultante en equivalentes/L será aproximadamente de :
a) 1 b) 2 c) 3
d) 4 e) Ninguno
de los valores dados
23.Aunque posiblemente no lo creas, por la orina también eliminas sulfatos, en forma de sales, procedente de la oxidación del azufre contenido en las proteínas. Menos mal que al ser neutralizado, no origina ácido sulfúrico, porque éste atacaría nuestros tejidos produciéndonos la muerte. Si se hacen reaccionar 20mL de tetraoxosulfato(VI) de hidrógeno 2N, con cantidad suficiente de sulfuro de dipotasio, con un rendimiento del 70%, y el gas producido se disuelve en 5L de agua, la molalidad de la disolución ácida obtenida será aproximadamente en mol.kg-1:
a)0,001 b)0,002 c)0,003 d)0,004 e) Ninguno de los valores
dados
R=0,082 atm.L. K-1 mol-1
24*. La producción de ácido sulfúrico por parte de un país, mide su nivel de industrialización. Sin embargo es un gran contaminante, y provocador de lluvia ácida, con las consecuencias que conlleva. El petróleo tiene una buena proporción de azufre, debido a su procedencia, que por oxidación y posterior catálisis se oxida hasta producir este ácido, por eso la combustión de hidrocarburos produce dicha contaminación. Sin embargo cuando se prepara una disolución diluida de un ácido sulfúrico tomando 25 mL del concentrado al 98% con una densidad de 1,86 gcm-3, y diluyéndolo hasta completar 250mL de disolución de densidad 1,3gcm-3 podrás decir de esta última que:
a) Es 1,86 M b) es
casi 1m c) es 3,6N d) Tiene un 14% de riqueza
e) Contiene 15,5 moles de disolvente puro
Masa molar del ácido sulfúrico=98gmol-1