ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
TERMODINÁMICA 16. Variables de
estado. Primer Principio de Termodinámica
301.Mayer que era médico mercante, observó de que la sangre venosa era
excesivamente rojiza en los trópicos como si fuera arterial, o sea tenía
oxígeno en exceso que no era consumido, porque se necesitaba menor calor
animal, por lo tanto quemando menor cantidad de alimento, se podía desarrollar
más trabajo, o sea que el calor y
trabajo eran intercambiables. A partir de este momento y hasta alcanzar la
primera mitad del siglo XIX, se produce una verdadera carrera para calcular su
equivalente. Inicialmente el equivalente
entre W y Q era de 3,56J/cal, calculándolo midiendo la temperatura alcanzada
por una mesa de agua, cuando otra caía sobre ella desde una determinada altura.
Joule lo mejoró hasta 4,2J/cal (empleó la escala inglesa y el valor dado es una
conversión). Actualmente está reconocido un valor de interconversión de 4,184J/cal. Los experimentos para calcularlo se basaron en el efecto que
producía sobre una masa:
a) de agua, la
caída de otra masa b)
de hielo, la mezcla con otra masa de agua
c) de agua, el
movimiento de otro cuerpo d)
de hielo, la fusión al calentarlo
302.
En 1845, Joule decía “Si mis resultados son correctos y la temperatura sube 1º con una caída de 817
pies, la subida de la temperatura en las cataratas del Niágara, supondría 1/5
de grado, para una caída de 160 pies.”. Este hecho implica la conversión de:
a) Energía
cinética en calor b)
Energía potencial en calor
c) Trabajo en
calor d)
Energía potencial en energía interna
303*.
En 1849, Joule, publica “El equivalente mecánico del calor”. En ese trabajo
presentado en la Royal Society de Londres se decía
que 772 libras –pie de trabajo producirían el calor necesario para calentar
1ºF, una libra de agua. En unidades no anglosajonas daría un factor de
conversión de 4,154 J cal-1. Según la conversión inicial:
a) La energía
potencial es equivalente al trabajo b)
La energía cinética es equivalente al trabajo
c) El calor es equivalente a la energía potencial d) El calor es equivalente al trabajo
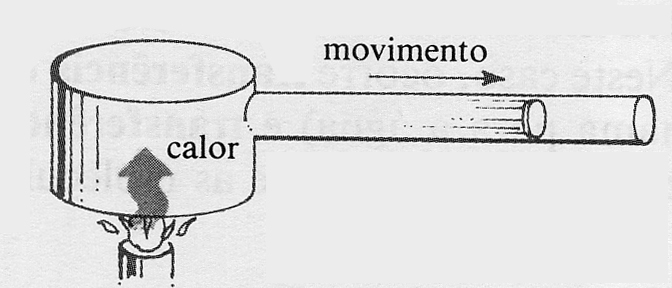
304*.El
dibujo de la figura, describe la conversión del calor en:
a) energía
potencial b) energía cinética
c) energía interna d)
trabajo

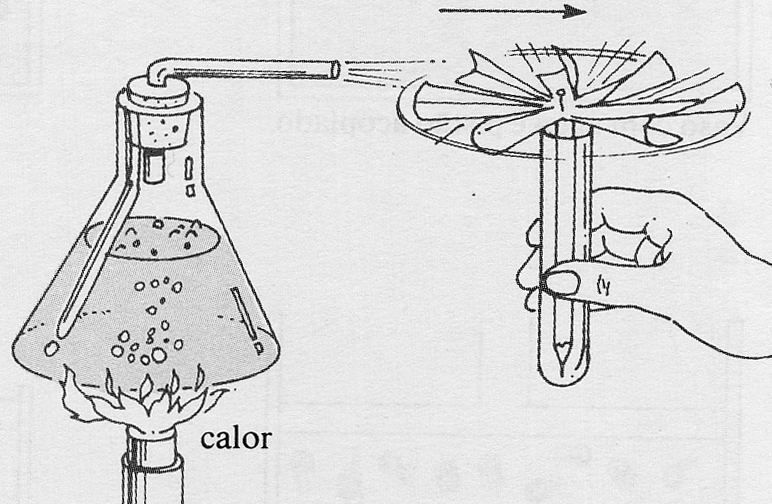
307*.
El dibujo adjunto señala una conversión de energía calorífica en :
a) trabajo de expansión b) energía potencial
c) energía cinética d)
energía interna
308*.Aunque
ya en 1693, el filósofo alemán Leibniz, había postulado el principio de
conservación de la energía mecánica (sin esos términos). Fue, Helmholtz , el que en 1847, en su trabajo “Conservación de la fuerza”, formula el
primer principio de termodinámica, de forma parecida a como lo conocemos. Sin
embargo la expresión original de éste fue: variación de la energía = calor –
trabajo efectuado, dado que:
a) No se conocía
el concepto de energía interna
b) La energía
empleada era un término genérico
c) El trabajo efectuado lo realizaba siempre el
sistema que evoluciona
d) No se tuvieron en cuenta los criterios de signos en dicha expresión
310*.
Actualmente la expresión del primer principio de termodinámica no se parece exactamente a la dada
inicialmente dado que existe un criterio de signos aplicado a la energía, que
implica que siempre que un sistema transfiera energía en cualquiera de sus modalidades, ésta será
siempre negativa, mientras que la recibe, será positiva, por ello si tenemos un
sistema gaseoso encerrado en un recipiente que evoluciona hasta un estado final
sin variar la presión, y los alrededores aumentan su temperatura podrás
asegurar que en dicha evolución:
a) No varía la
masa por ser un sistema aislado b)
No varía el volumen por ser un sistema cerrado
c) No varía la temperatura del sistema d) la variación de energía interna será negativa
309*.
El dibujo adjunto señala una conversión del calor en:
a) energía cinética de rotación b) energía interna
c) trabajo de expansión d) energía potencial
311*.
En el dibujo de la figura, se le comunica calor a un sistema formado por un gas
monoatómico. Si el volumen del recipiente se conserva constante, dirás que el
calor:
a) se ha transformado en trabajo b) ha aumentado la energía
interna del sistema
c)
ha aumentado la presión del sistema d)
ha aumentado la temperatura del sistema
312.
Un sistema realiza un trabajo contra la pared, deformándola, cuando se
expansiona, con lo cual aumenta su volumen, y este trabajo contra la presión
externa que lo aprisiona es siempre:
a) Mayor que cero
b) Menor que cero
c) Cero
d) Depende de la temperatura
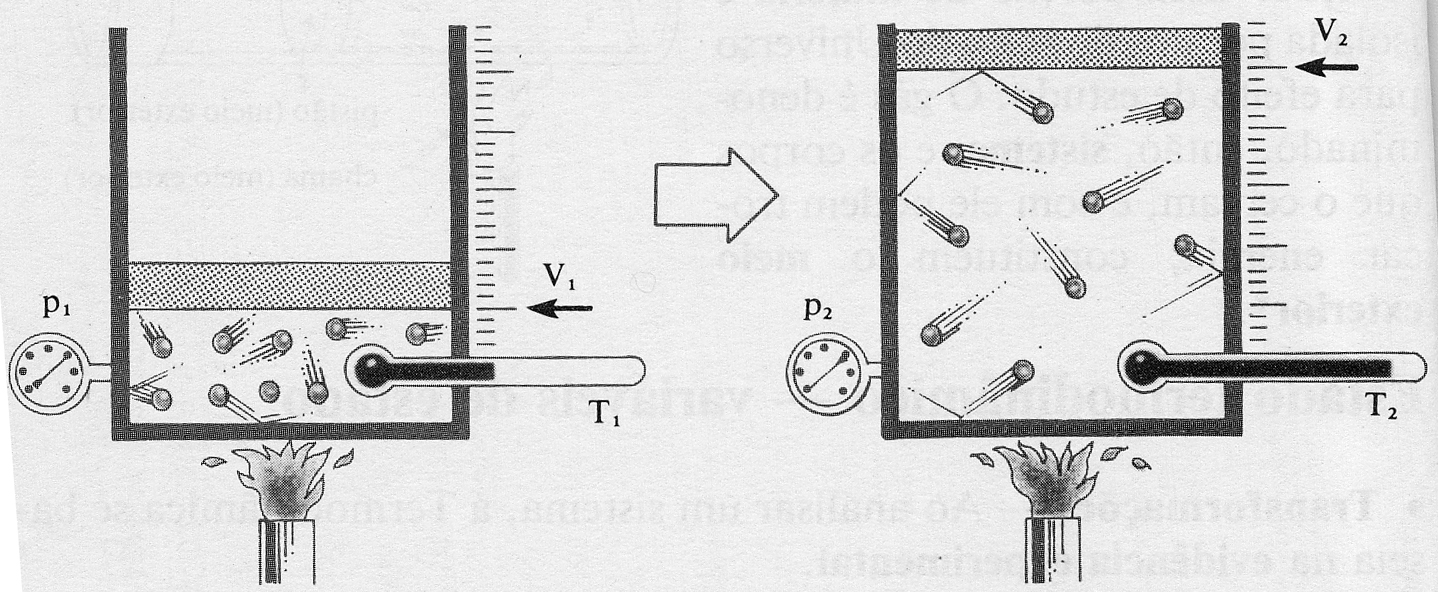
313*.
Se le comunica calor a un sistema gaseoso, a una presión constante. Si observas
con detenimiento el dibujo, dirás que:
a) Aumenta el número de choques con las paredes
b) El volumen se cuadriplica
c) El trabajo de expansión se cuadriplica
d) La energía interna se duplica
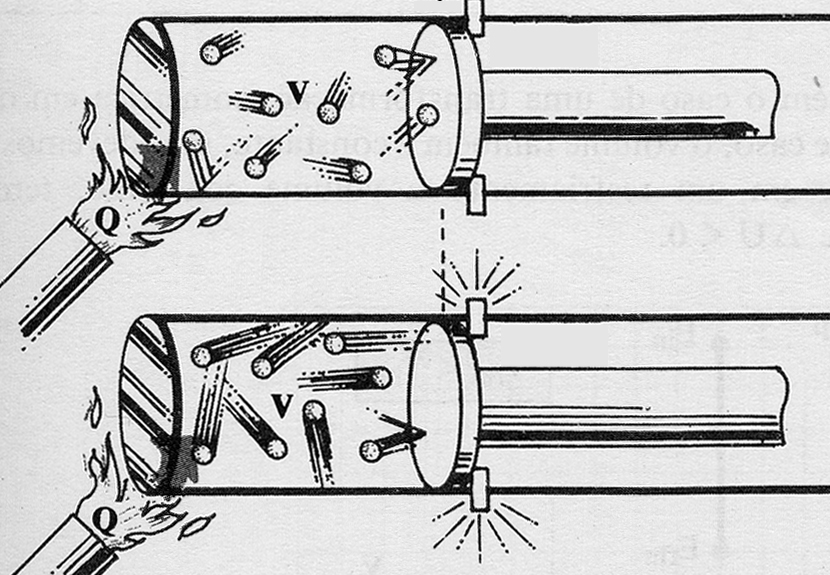
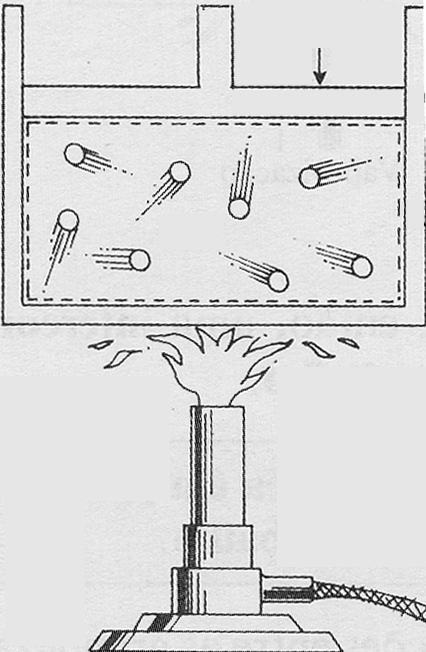
315. La descripción microscópica de los efectos de la
aplicación de calor a un sistema gaseoso, que se puede apreciar en el dibujo,
implica que la energía calorífica comunicada se empleó en:
a) aumentarle la presión b)
aumentarle la temperatura
c) hacer un trabajo d)
aumentarle la energía cinética
316.
Los conceptos de capacidad calorífica a P constante (CP) y a V
constante (CV) para un mol de un gas, vistos en test anteriores, son
muy importantes, ya que permiten relacionarlas entre sí a partir del primer
principio de termodinámica, si dividimos las magnitudes que lo expresan por la
variación de temperatura, se obtiene una expresión que se conoce como ley de
Mayer tal como:
a) CV =CP +W b) )U=
CP +W c) CV =CP +R d) CV =CP -R
317*.La
capacidad calorífica depende del estado físico de la sustancia a que hace
referencia, dado que:
a) En los sólidos y en los líquidos, la presión no
les afecta
b) Solo en los gases existe una relación entre las
variables de estado
c) La dilatación de los sólidos es despreciable
comparada con la de los gases
d) Solo los gases tienen los grados de libertad necesarios
313*.
Se le comunica calor a un sistema gaseoso, a una presión constante. Si observas
con detenimiento el dibujo, dirás que:
a) Aumenta el número de choques con las paredes
b) El volumen se cuadriplica
c) El trabajo de expansión se cuadriplica
d) La energía interna se duplica
314.
El término termodinámica, fue propuesto por Kelvin en 1798, al explicar el
calor desarrollado en la fricción. Cuando hace frío y te frotas las manos y
aplicas el primer principio de termodinámica al sistema formado por tus manos
los alrededores con los que intercambias la energía:
a) DU=Q+W
b) DU=Q-W
c) DU=DH+W
d) DU=Q
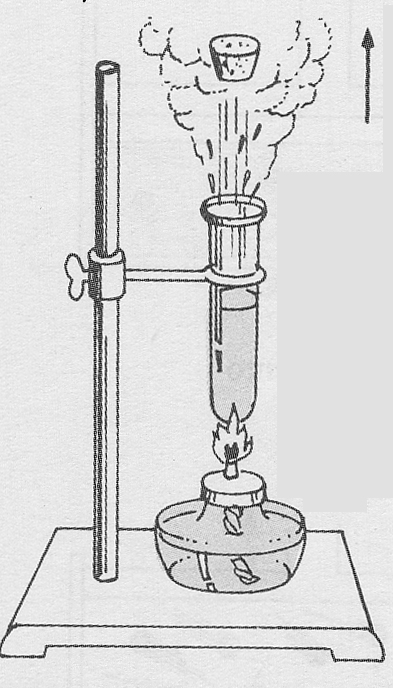
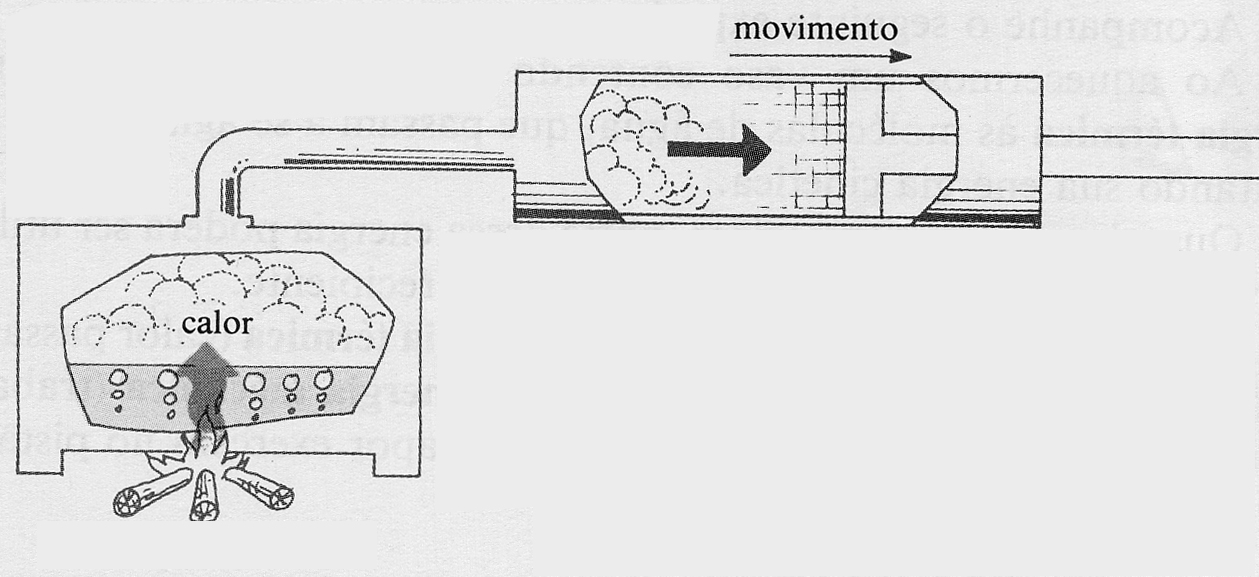
318*. En el dibujo dado, se observa como el calor
comunicado a un sistema agua-vapor de agua, es capaz de producir el movimiento
de un émbolo en una máquina térmica. De las transformaciones en curso podrás
decir que implica que la energía calorífica comunicada se empleó en:
a) aumentar la presión
b)
producir un cambio de estado
c) hacer un trabajo
d) aumentar la energía cinética
319. El término entalpia, sugerido
por Helmholtz pero propuesto cuarenta años después, en 1909, por el
holandés Kammerlingh-Onnes, el descubridor de la
superconductividad, procede del griego thalpos (
![]() , calor), con el prefijo
, calor), con el prefijo
![]() que indica interioridad, o sea sería una especie de calor
interno, simbolizándose por error con la letra H que debería corresponder con letra griega ega, si entalpía se escribiera inicialmente con dicha
letra, y no con épsilon , y con la inicial de calor en inglés (lo cual será simple coincidencia).
La variación de entalpía es una magnitud que representa:
que indica interioridad, o sea sería una especie de calor
interno, simbolizándose por error con la letra H que debería corresponder con letra griega ega, si entalpía se escribiera inicialmente con dicha
letra, y no con épsilon , y con la inicial de calor en inglés (lo cual será simple coincidencia).
La variación de entalpía es una magnitud que representa:
a) Energía
cinética de las moléculas del sistema
b) Energía
potencial de las moléculas del sistema
c) El calor
intercambiado por el sistema a presión constante
d) La energía
interna del sistema
320*.Inicialmente
el contenido calorífico fue representado por una W, por una I, e incluso por la
letra griega
![]() , de forma que
, de forma que
![]() = E+PV. El mismo Gibbs la definió
en 1875, como “función calor a presión constante”, aunque no empleó la palabra
entalpía. De esta forma la variación de entalpía de un sistema representa:
= E+PV. El mismo Gibbs la definió
en 1875, como “función calor a presión constante”, aunque no empleó la palabra
entalpía. De esta forma la variación de entalpía de un sistema representa:
a) El calor
cedido por el sistema a sus alrededores
b) El
intercambio de energía calorífica entre un sistema y sus alrededores, a presión
constante
c) La variación
de energía interna si no se modifica el volumen del sistema
d) El trabajo
desarrollado
305.
De Rumford, nacido norteamericano de Massachussets, como Benjamín Thomson,
y posteriormente convertido en ciudadano inglés y conde de Rumford,
se cuentan muchas anécdotas, como la que hace mención a la viuda de Lavoisier,
con la que contrajo matrimonio y pronto se separó."Realmente, Lavoisier, al morir guillotinado, había tenido mucha suerte",
dijo tras su divorcio. Sin embargo, aparte de destruir teorías obsoletas sobre
el calor (teoría del calórico) enunció el primer principio de termodinámica que
se basaba en:
a) La
conservación de las fuerzas vivas b) La conservación de la energía
mecánica
c) La
conservación de la cantidad de movimiento d)
La conservación de la energía interna
306.
Aunque quizá, no lo creas, el inventor de la máquina de hacer café, así como de
la sopa de los pobres, fue el conde Rumford, que de
agente secreto británico en la Norteamérica revolucionaria, y fundador de la Royal Institution en Londres, llegó a ser el segundo
hombre más poderoso de Baviera.
a) DU=Q+W b) DU=Q-W c) Q=DU+W d) W=DU+Q