
Fig.1
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
PRECIPITACIÓN DE SALES DE Ag1+
4. Nitrato de plata y tiocianato
potásico
Partimos de 2 gotas de nitrato de plata e tiocianato potásico disuelto en agua. Las unimos (fig.1). Rápidamente se produce un precipitado blanco de AgSCN (Kps=1,3.10-12), que se extiende a las dos gotas (fig.2-8). Pasado cierto tiempo el precipitado comienza a cristalizar (fig.9).

Fig.1

Fig.2

Fig.3
Fig.13
El proceso que tiene lugar es:
2NH3 (ac)+ AgSCN(s)= [Ag(NH3)2]SCN
(ac)
Fig.12
 Fig.10
Fig.10

Fig.4

Fig.11

Fig.14
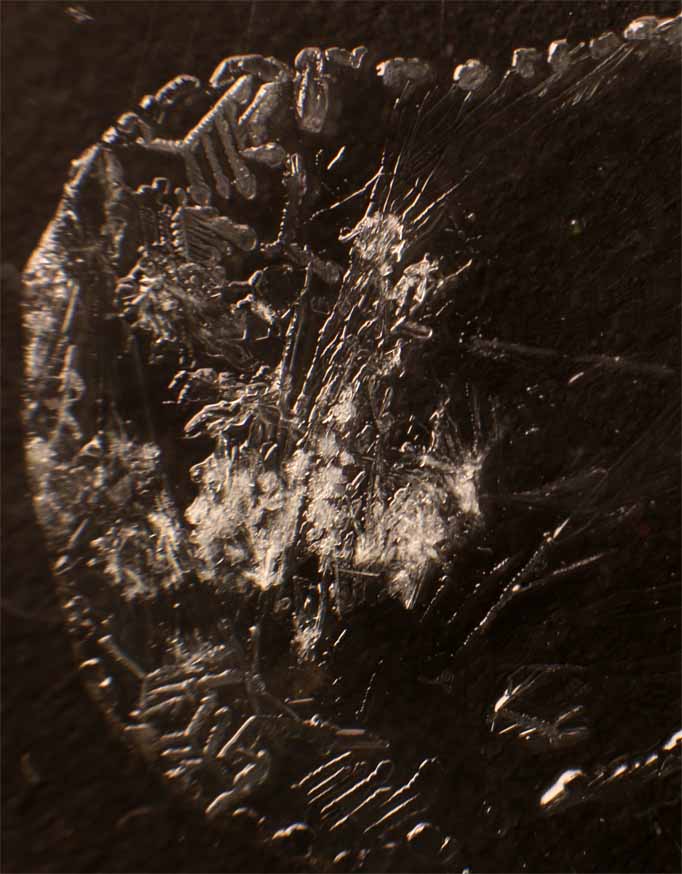
Fig.9
Fig.5 (ampliación)
El proceso que tiene lugar es:
AgNO3 (ac)+ KSCN (ac)= AgSCN(s)+ 2KNO3
Precipitado blanco
Disolución del precipitado por formación de complejos amoniacales de plata I. Al agregarle una gota de hidróxido amónico, se va disolviendo.(fig.10-14).

Fig.7(detalle)

Fig.8
Fig.6 (contraste)