ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
INDICADORES QUÍMICOS ÁCIDO-BASE
II
Indicadores ácido-base sintéticos
La segunda mitad del siglo
XIX, fue el inicio de las grandes síntesis orgánicas, y como no podía
ser menos, también los indicadores
ácido base, que habían sido empleados como productos naturales, iban a
ser sintetizados a partir de 1868.
El primero
indicador en ser sintetizado fue la fenolftaleína
[1]
, conseguida por Baeyer condensando el anhídrido del
ácido ftálico (ortobencenodicarboxílico), con fenol, en 1871. De la fenolftaleína
salieron otros muchos indicadores, potenciando los cambios de absorción
al introducir derivados sulfonados
y bromados, estudiados por Lubs y Clark a partir de 1915. Así aparecieron
el rojo fenol, el azul de timol, la timolftaleína, el azul de bromotimol,
azul de bromofenol y el cresol entre otros.
Antes,
en 1859, el francés Verguin, había obtenido la fuchina
[2]
, oxidando por casualidad la anilina con cloruro de
estaño(IV), que también fue obtenida por Hofmann poco después.
Este compuesto sería el punto de
partida de otros indicadores con estructura de trifenilmetano, como el
violeta de metilo, verde de metilo, el verde brillante, el verde malaquita
etc, caracterizados por tonalidades fuertes y brillantes a distintos pH.
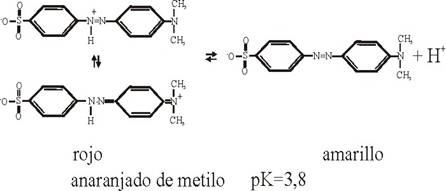
Otra ruta de síntesis de indicadores fue de los colorantes azoicos, que dio lugar al naranja de metilo (propuesto por Lunge en 1878). El segundo indicador ácido-base de este tipo en ser empleado, fue el rojo Congo [3] , descubierto por Böttiger en 1884. Después se usarían el rojo de metilo (introducido por Rupp y Loose en 1908), amarillo de alizarina etc. De estructura algo diferente entre los colorantes azoicos y el tipo fuchina es el rojo neutro que también será empleado en este trabajo.
Uso de los indicadores ácido-base sintéticos.
Por lo general se suelen emplear en forma de sales sódicas, por ser solubles en agua. En caso contrario, se disolverían en etanol, lo cual tiene mas inconvenientes a la hora de usarse en la química a la gota, ya que la gota de alcohol tiende a extenderse y desparramarse contactando antes de tiempo con los diferentes medios.
Dado que se conocen los distintos pK, en los equilibrios tautoméricos entre las formas con distinto color y como se ha explicado anteriormente, en el tema Indicadores ácido-base I, el cambio de color o viraje se produce aproximadamente entre una unidad menos y otra mas del pK, se pueden comprobar los distintos cambios de color. Muchas veces el color esperado no es el que aparece, pues dado que se trata de formas en equilibrio, la combinación de colores produce el que se aprecia.
La tabla de indicadores sintéticos empleados y sus cambios de color en función del pH, es la dada, señalándose las regiones del viraje:
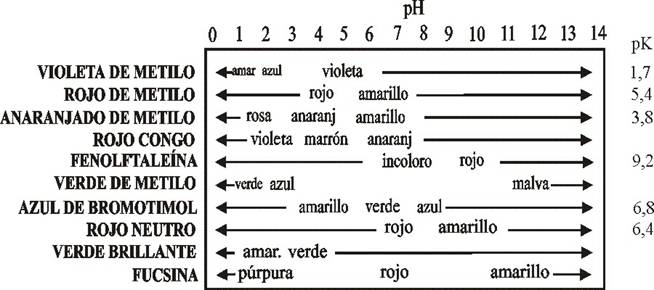
Problemas en su uso:
Los cambios
de color que se dan anteriormente, pueden experimentar numerosas variaciones,
especialmente en la fotografía a la gota, que necesita de focos de luz,
para poder captar desde muy cerca las variaciones de color. Estos focos
producen un cierto calentamiento del sistema, que alteran el producto
iónico del agua
[4]
. De forma que al aumentar la temperatura, se desplaza
hacia el lado alcalino la coloración ácida del indicador sensible a las
bases, por lo que un cambio de color tendrá lugar a una concentración
de OH- mayor que a la
temperatura normal. Con indicadores sensibles a los ácidos, esta desviación
de la región del viraje, se produce hacia el lado ácido. De esta forma
el anaranjado de metilo que tiene una región de viraje entre pH 3,1 y
4,4 a 18ºC, pasa a ser entre 2,5
y 3,7, si la temperatura aumenta hasta los 80ºC.
Muchos de
los colores indicados en la tabla en la región descrita, se producen por
mezcla de otros colores, como por ejemplo en el caso del azul de bromotimol,
cuyos cambios de color se deben a las absorciones de la luz de las siguientes
formas en equilibrio
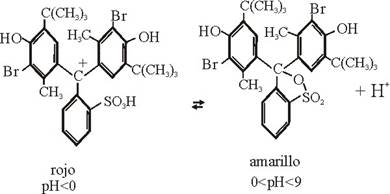
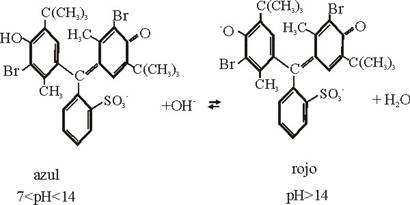
La
aparición del color verde en el medio de la región, se debe a la combinación
de los colores azul y amarillo de las formas en equilibrio
entre pH 6 y 8. Lo mismo ocurre con las combinaciones azul y rojo
que produce una tonalidad violácea, a pH
elevado.
En otros indicadores, como el anaranjado de metilo o naranja de metilo (del tipo diazoico), dado que el cambio de color es menos radical (rojo-amarillo), no se producirá este fenómeno.
1. Fucsina o fuchina.
El mecanismo empleado es mismo
descrito en Indicadores ácido-base 1. O sea se disponen en una caja Petri
cuatro gotas, de ácido acético 1N, ácido sulfúrico 6N, hidróxido amónico 1N e hidróxido sódico 6N,
aproximadamente en los vértices de un cuadrado, y en su centro la gota
de indicador (fig.1). Cuando éste está disuelto en alcohol, deberá dejarse
mas sitio dado que la gota por su menor tensión superficial tiende a extenderse.
Se unen las gotas (fig.2), y se observa la difusión de los diferentes
medios a través del indicador (fig. 3 y 4)
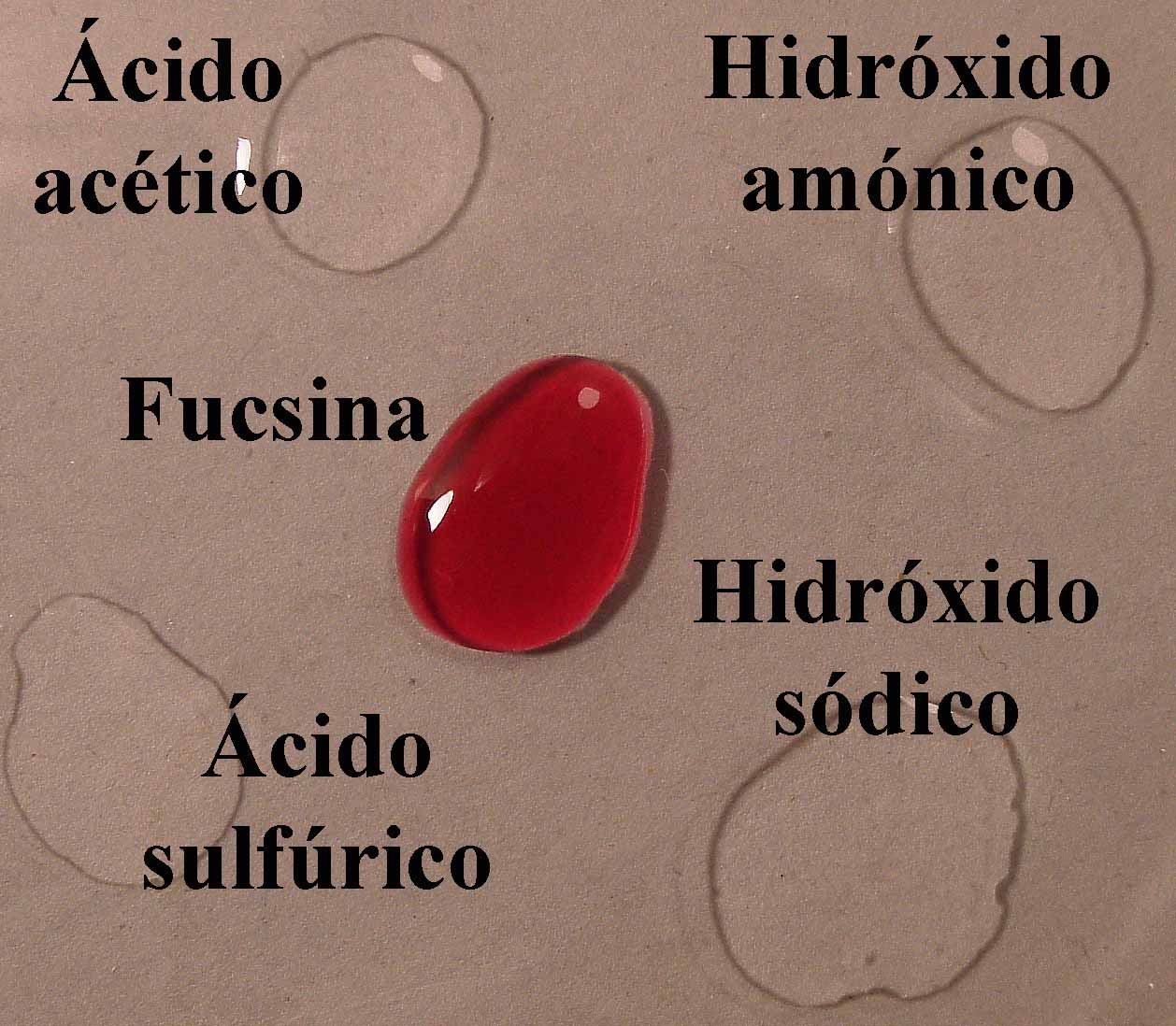
Fig.1
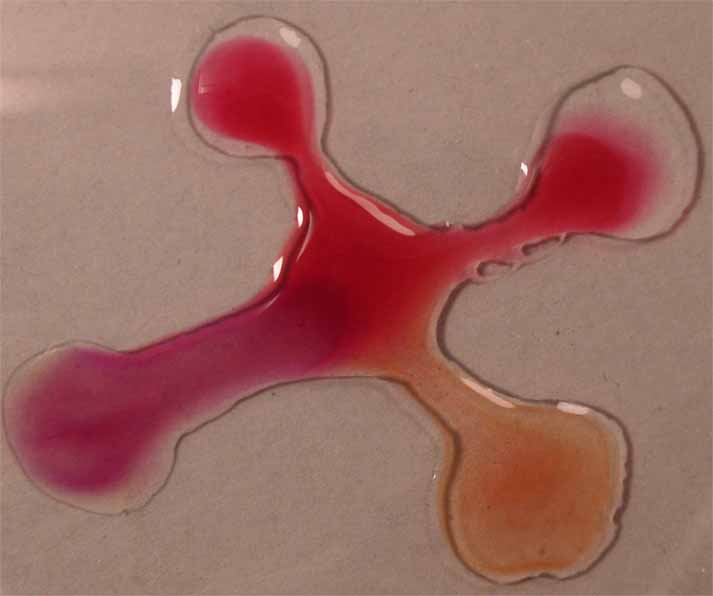
Fig.2
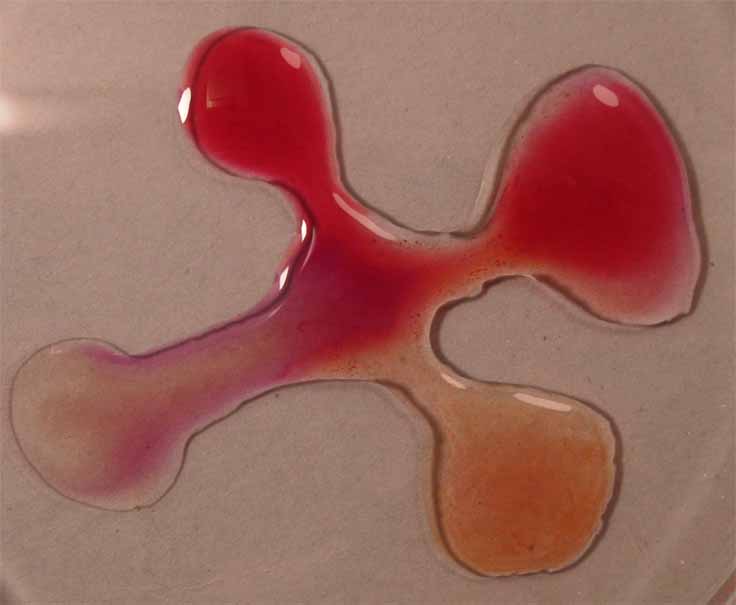
Fig.4
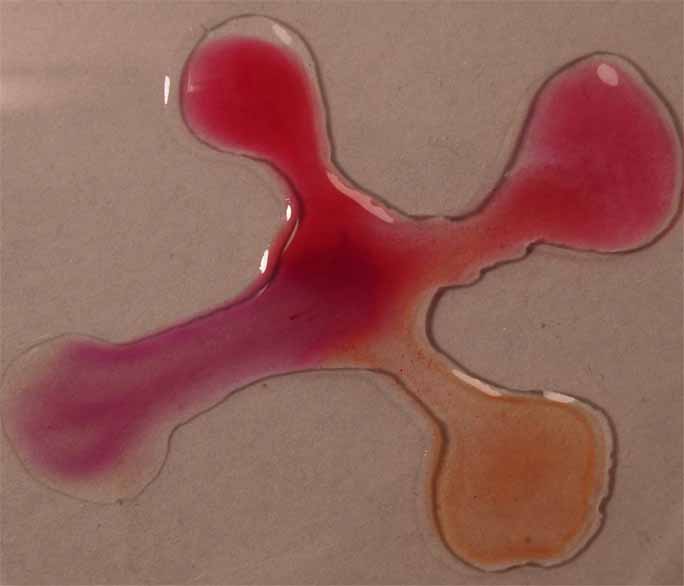
Fig.3
2. Violeta de metilo
Se sigue la misma técnica anterior obteniéndose la sucesión
de fotos de las figuras 5 a 8.

Fig.5
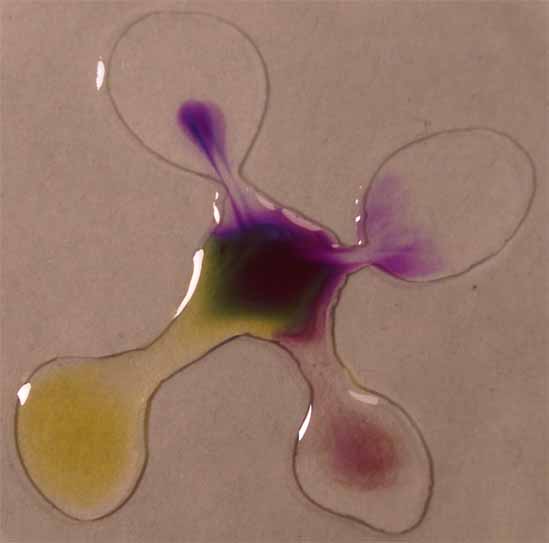
Fig.6
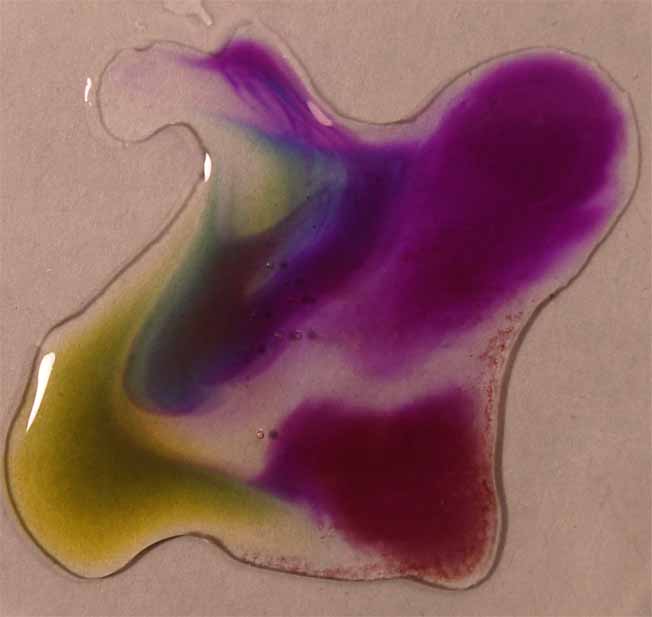
Fig.8
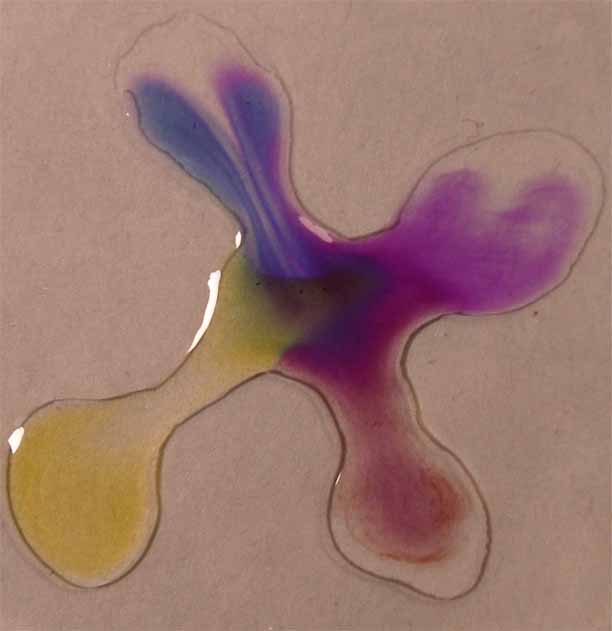
Fig.7
El
violeta de metilo destaca por los colores brillantes que toma, cambiando
de color varias veces en el intervalo de pH 0-14. Sin embargo estos cambios
son una demostración clara de la mezcla de colores
por ejemplo el verde por combinación de azul y amarillo.
3. Verde de metilo
Se sigue la misma técnica anterior
obteniéndose la sucesión de fotos de las figuras 9 a 12.
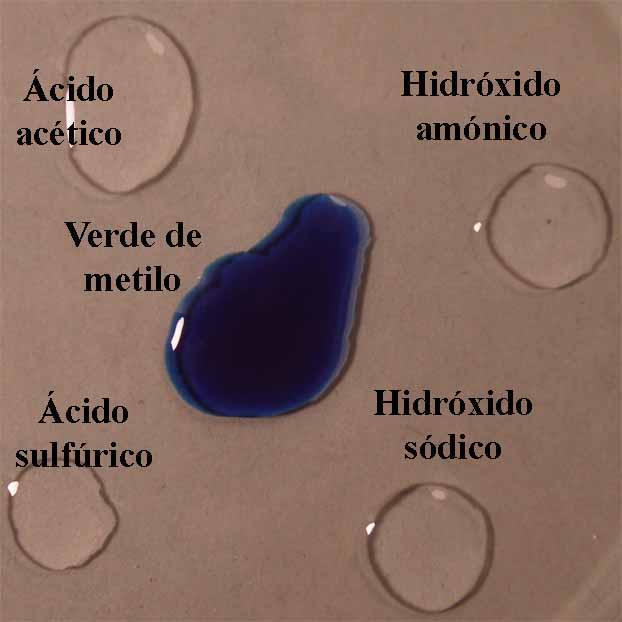
Fig.9
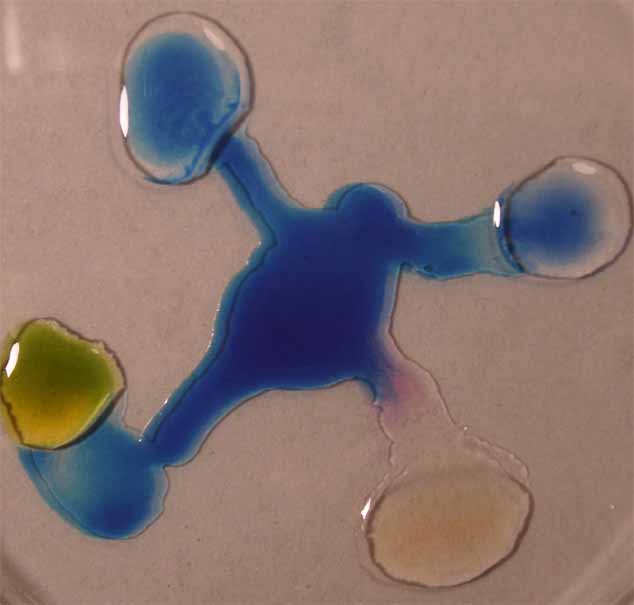
Fig.10
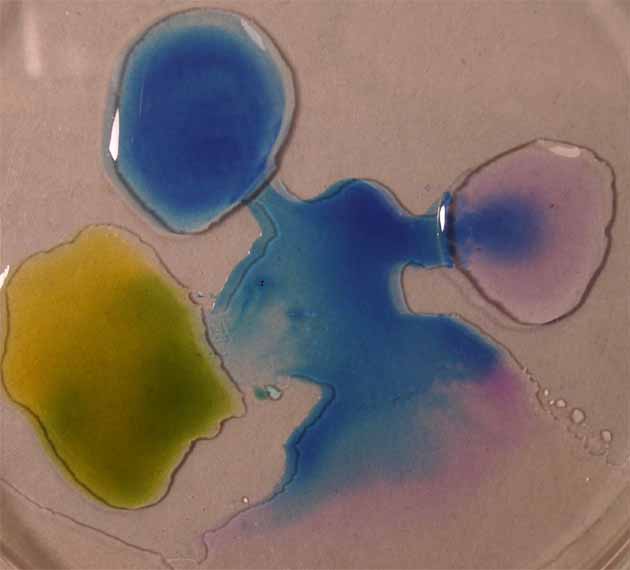
Fig.12
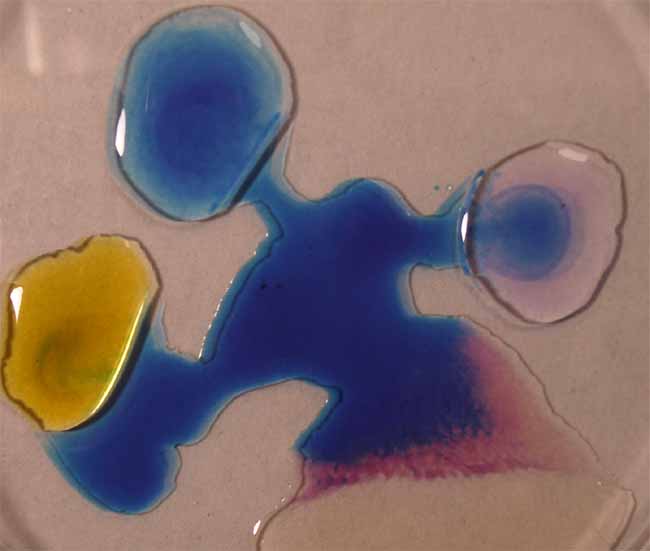
Fig.11
4.
Anaranjado de metilo
Se sigue la misma técnica anterior obteniéndose la sucesión de fotos de las figuras 13 a 16.
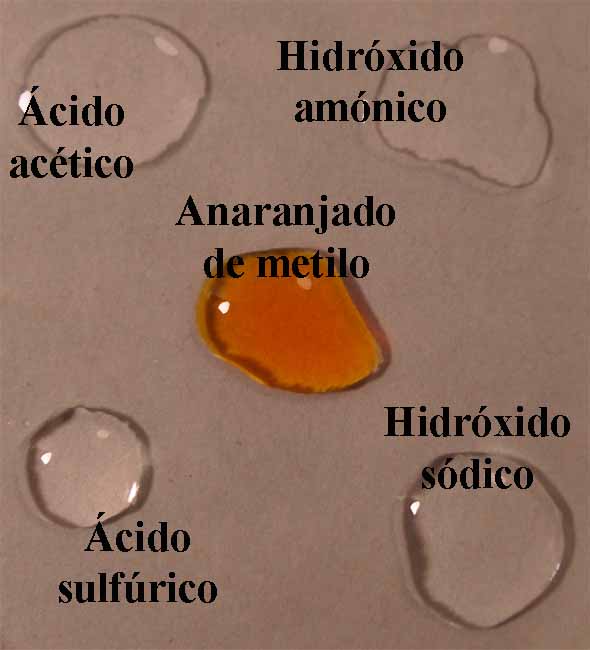
Fig.13
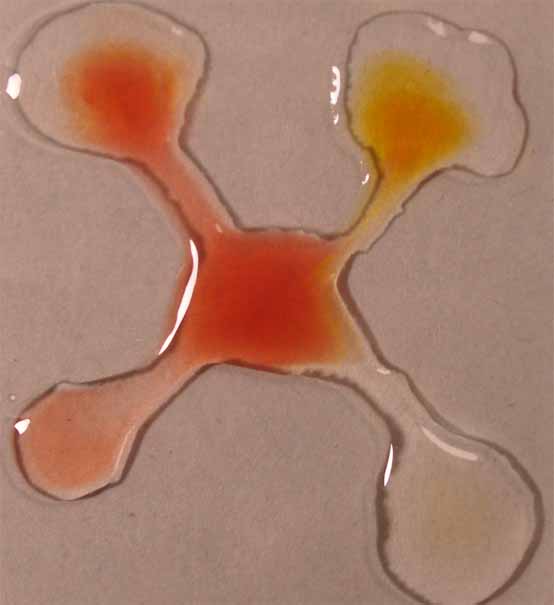
Fig.14
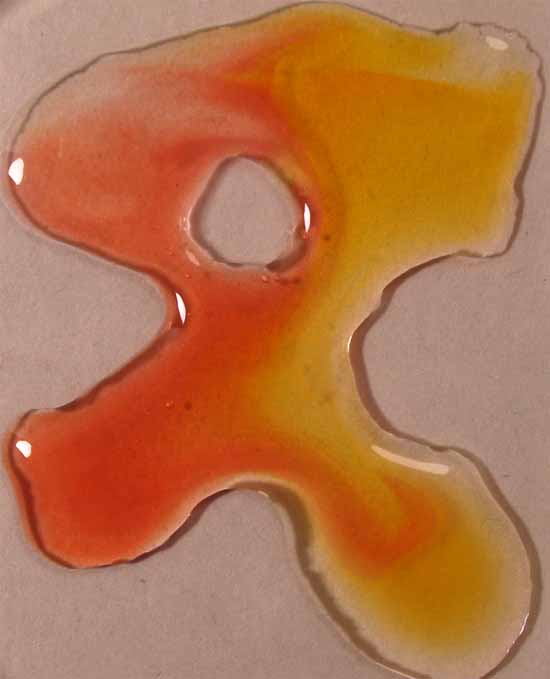
Fig.16
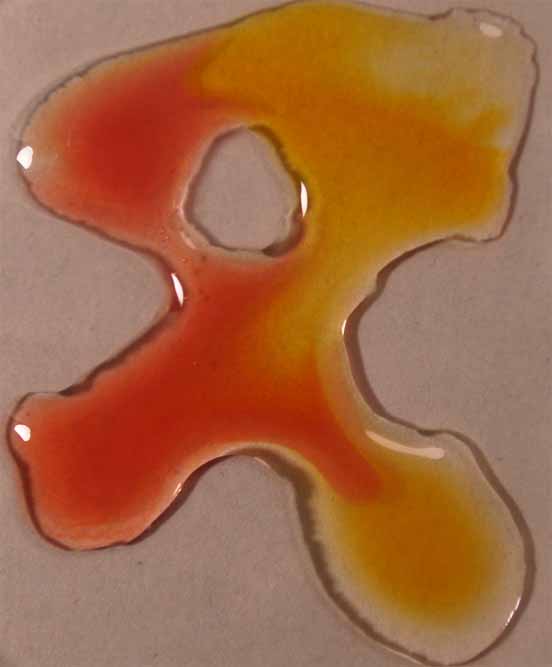
Fig.15
5. Rojo de metilo
Se sigue la misma técnica anterior obteniéndose la sucesión de fotos de las figuras 17 a 20.
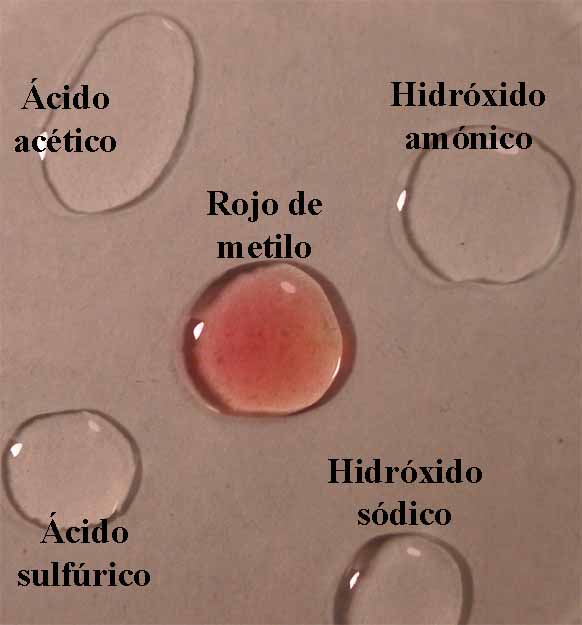
Fig.17
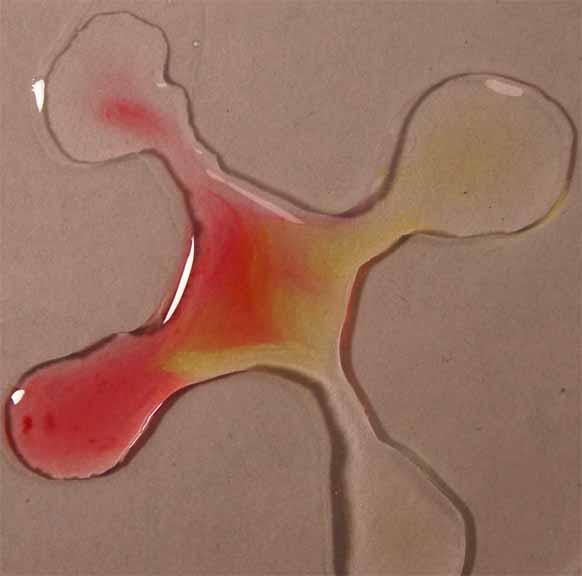
Fig.18

Fig.20
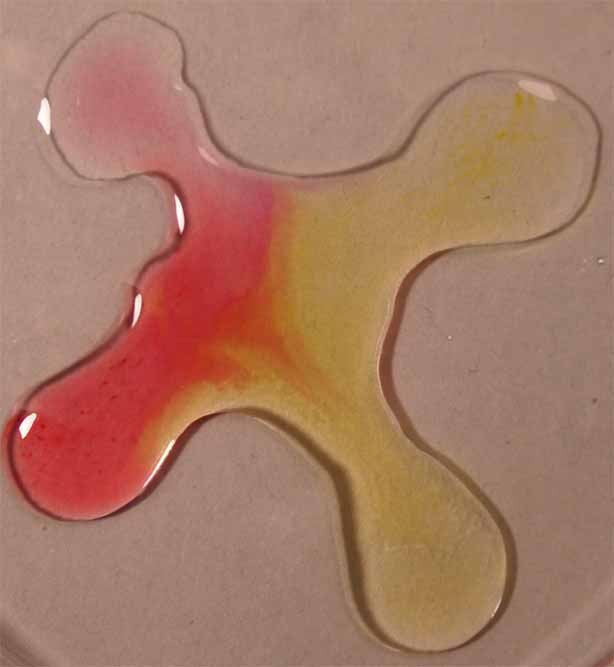
Fig.19
6. Rojo Congo
Se sigue la misma técnica anterior obteniéndose la sucesión de fotos de las figuras 21 a 24.

Fig.21
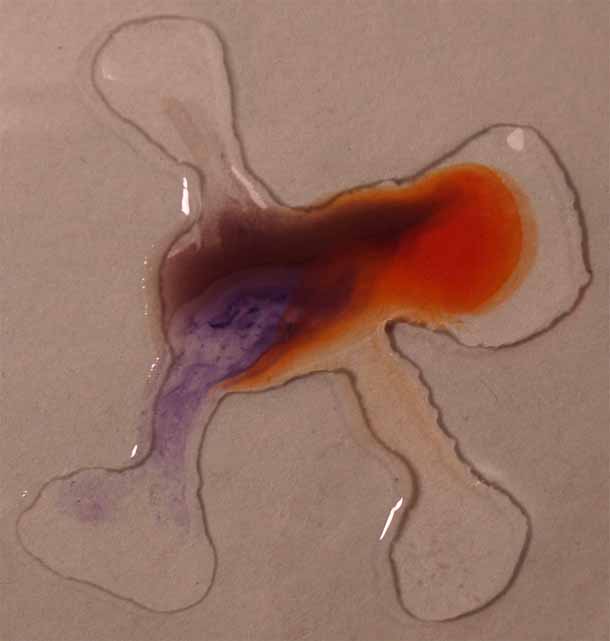
Fig.22
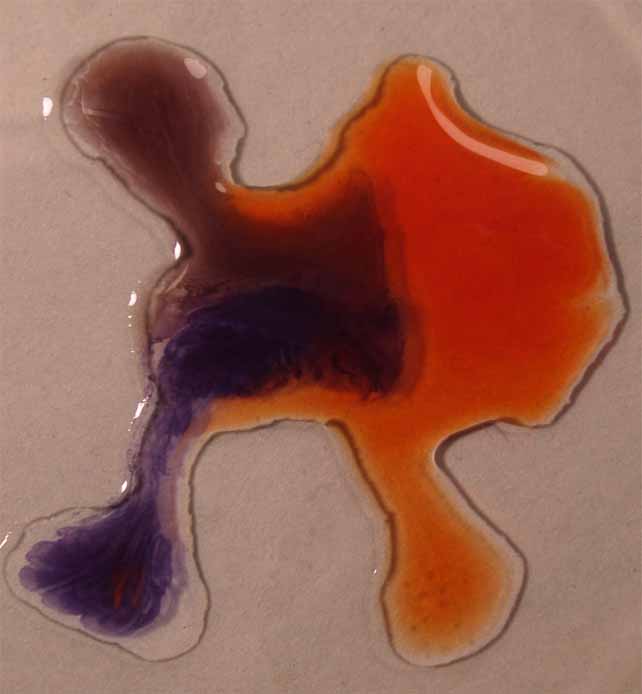
Fig.24
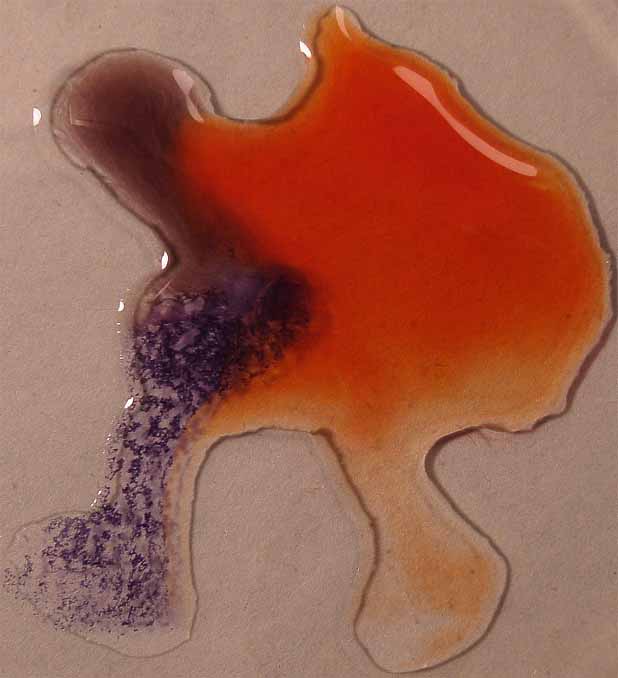
Fig.23
7.
Rojo neutro
Se sigue la misma técnica anterior obteniéndose la sucesión de fotos de las figuras 25 a 27.
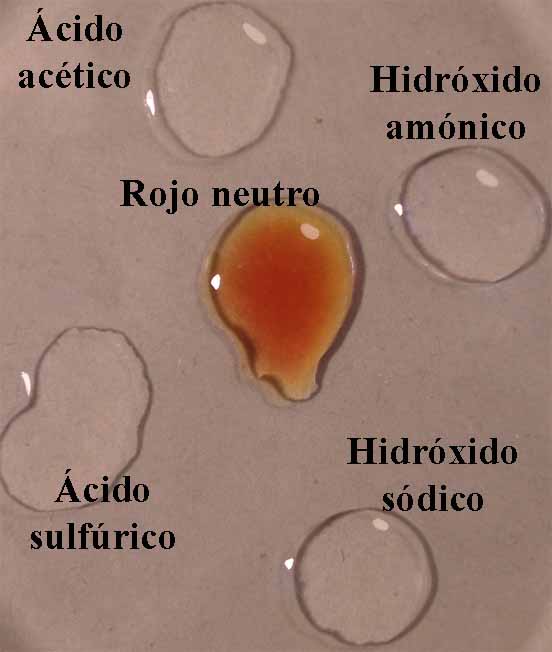
Fig.25
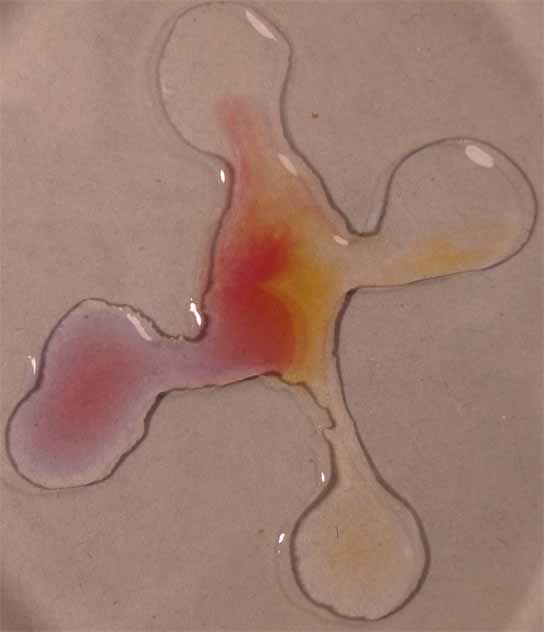
Fig.26
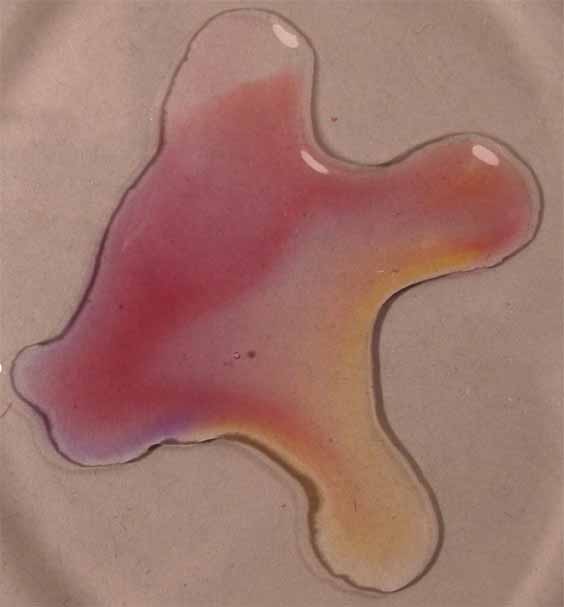
Fig.27
8.
Fenolftaleína
Se sigue la misma técnica anterior obteniéndose la sucesión de fotos de las figuras 28 a 31.

Fig.28

Fig.29

Fig.31

Fig.30
9. Verde brillante.
Se sigue la misma técnica anterior obteniéndose la sucesión de fotos de las figuras 32 a 34.
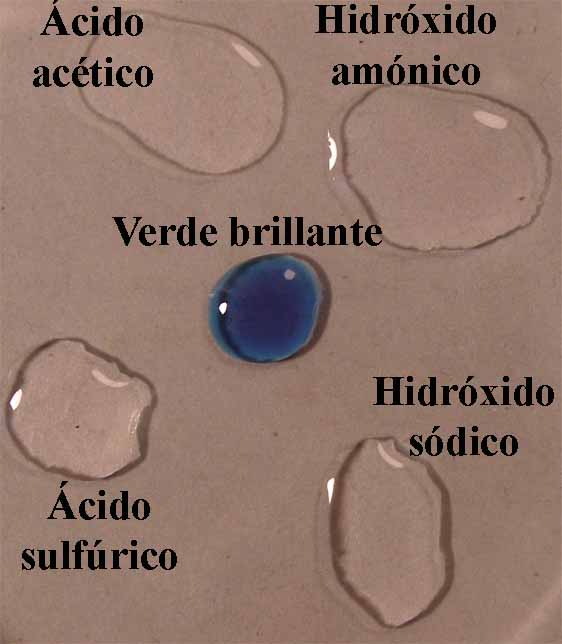
Fig.32
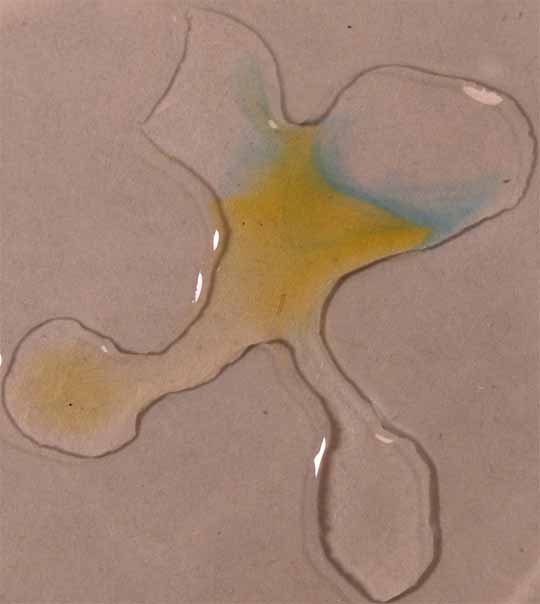
Fig.33
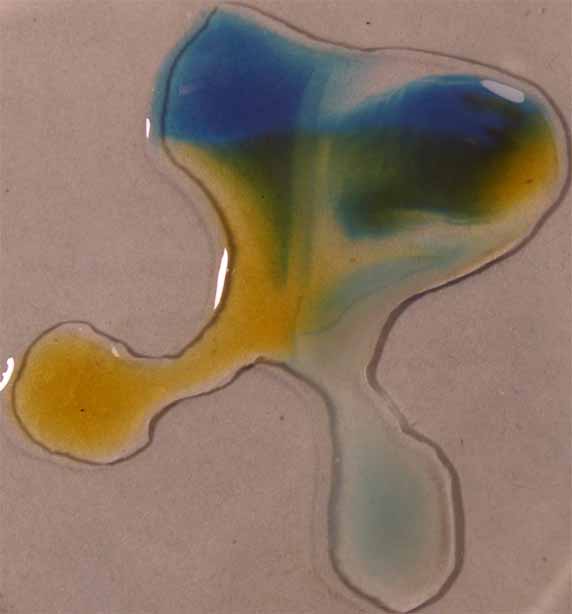
Fig.34
10.Azul
de bromotimol
Se sigue la misma técnica anterior obteniéndose la sucesión de fotos de las figuras 35 a 39.
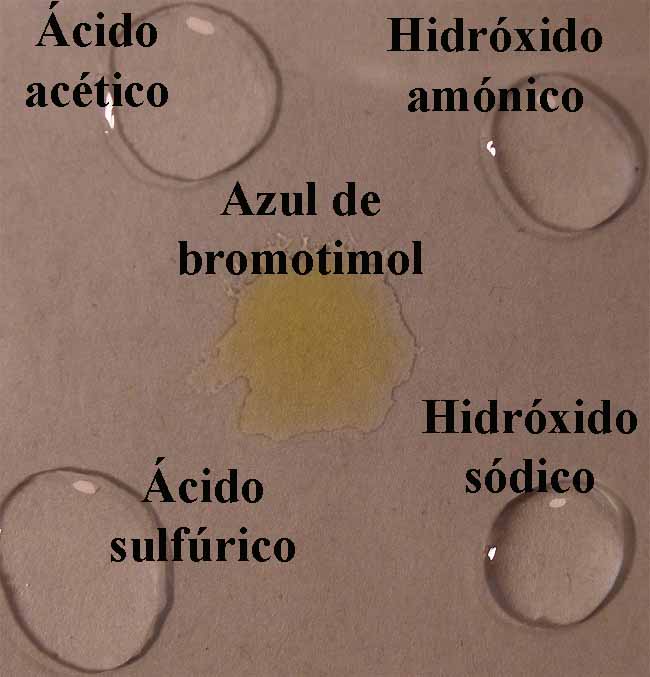
Fig.35

Fig.36
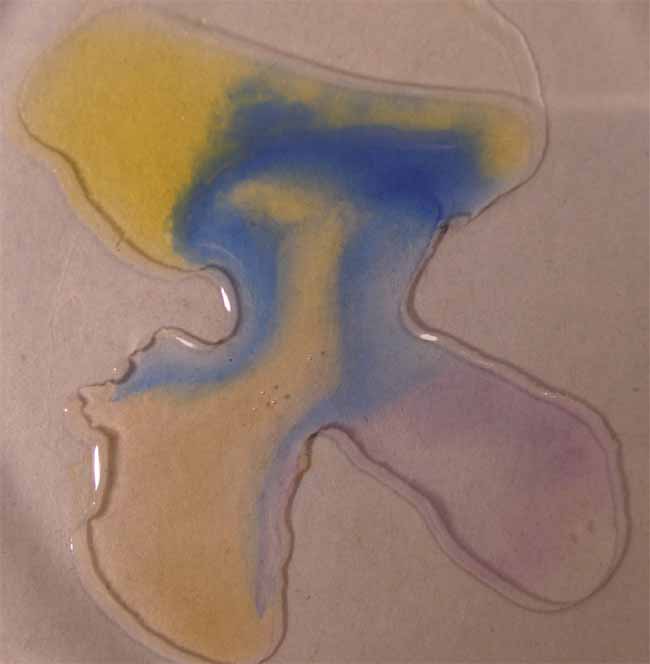
Fig.38

Fig.37
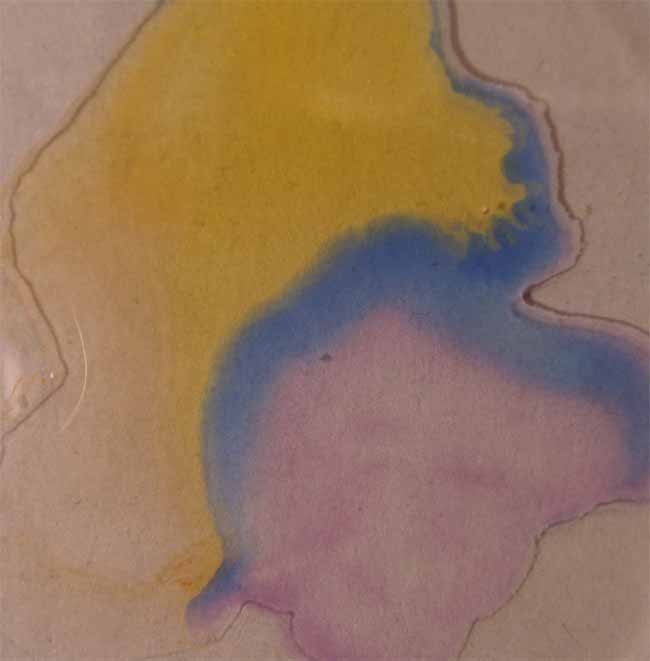
Fig.39
[1]
El
origen del nombre de la fenolftaleína, parece sencillo si nos remontamos
sólo a su sentido químico, sin embargo desde el punto de vista remoto,
el fenol deriva del griego phaino (nV4<T), con el significado de “yo alumbro”,
haciéndolo derivar del benzol (C6H6),que había sido descubierto por Faraday como residuo del gas
del alumbrado de Londres, y la ftaleína, procede del término nafta,
cuyo origen es muy remoto. Se podría considerar derivado del egipcio
Na-Ptah, por que era empleado en el culto del dios egipcio del
fuego, Ptah (Ftha), equivalente al Vulcano latino, ya que era un líquido
negruzco traído de Persia, que ardía muy bien (petróleo).
De él derivarán la naftalina, obtenida en 1820, por Garden como residuo
de la destilación del alquitrán de hulla, el naftaleno etc.
[2] Su origen procede del de la planta de color rojo, fucsia, nombrada así por el francés Plumier, en honor del botánico Leonhard Fuchs, que la descubrió y que coincidirá con el término alemán fuchs ( zorra), en francés, renard, nombre a su vez de la casa comercial Renard, que fabricó por primera vez la fuchina o fucsina en Lyon, en 1860.
[3]
Nombre
impuesto por el marqueting de la casa alemana AGFA, que lo comercializó
en 1888. Se eligió, debido a la fascinación
que ejercían los términos
africanos en la sociedad berlinesa, en la incipiente colonización de
aquel continente. El término Congo es un hidrónimo de origen incierto,
posiblemente portugués con alteraciones locales, ya que fue descubierto
por el navegante portugués Diogo Cam. No tiene lógica emparentarlo con
el bantú kong (montaña).
[4]
El
producto iónico del agua es 10-14, a 25ºC, lo que produce
un pKw=14. Si la temperatura disminuye, el pKw aumenta, hasta 14,5 a
15ºC, y si la temperatura aumenta, el pKw disminuye hasta 13,5 a 40ºC, que son los márgenes de temperatura
entre los que oscila las experiencias presentadas.