
Fig.1
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
ÁCIDO NÍTRICO CONCENTRADO Y MONEDAS II
3. Ácido nítrico
concentrado y moneda española de 50
céntimos de 1966
(Composición 1g
de Al)
Trabajando como en prácticas
anteriores, con una gota de HNO3 concentrado(fig.1), casi no reacciona, solo lentamente sobre la cara, que en principio se oscurece y
después se destruye el relieve en la cara sumergida en el oxidante (Fig.2-5).

Fig.1

Fig.2

Fig.3 (detalle)

Fig.4
El proceso redox que
tiene lugar es:
REDUCC: 6HNO3 +6e
= 6NO2 +6O2-+6H+
OXIDAC: 2Al - 6e = 2Al3+
____________________________________
6HNO3 +2Cu= Al2O3+ 3H2O+
NO2

Fig.5
4.Ácido nítrico y moneda española de una peseta de
peseta de 1989
(Peso y composición : 0,5g de aluminio)
Para poder comparar se toman 2 monedas A y B (fig.6). Solo la A se trata con ácido nítrico concentrado, mientras que la B permanece como testigo, dado que los resultados de las posibles reacciones son muy difíciles de apreciar. Trabajando como en prácticas anteriores, con una gota de HNO3 (fig.7) sobre la moneda A. Pierde el brillo y se oscurece su cara(fig.7).

Fig.6

Fig.8
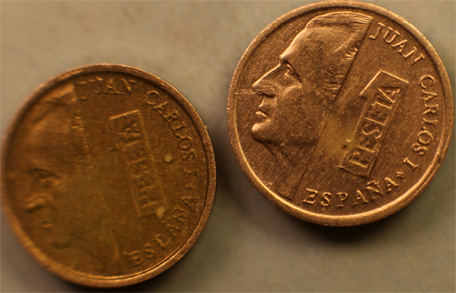
Fig.7
La reacciones son las mismas del caso anterior.
5.Ácido nítrico y moneda española de 5 céntimos de euro de
2006
(Peso y composición: 3,92g de acero recubierto de cobre).
Se trabaja con dos monedas, en este caso la A como testigo (fig.8)
mientras que la B se somete a la reacción química. En seguida se observa la
reacción con el cobre, produciendo las burbujas de NO2 y de NO (fig.9), atacándose completamente la
moneda (fig.10). Al cabo de 2 días ,aparece tal como fig.11.
Los procesos redox que
tienen lugar son:
REDUCC: 4HNO3 + 2e-
= 2NO2 + 2H2O + 2NO3 -
OXIDAC: Cu - 2e = Cu2+
____________________________________________
4HNO3 +Cu = Cu(NO3)2 + NO2 (gas) + 2H2O
REDUCC: 8HNO3 + 6e- = 2NO + 4H2O + 6NO3 -
OXIDAC: 3Cu - 6e- = 3Cu2+
_____________________________________________
8HNO3 +3Cu = 3Cu(NO3)2 +
2NO (gas) + 4H2O

Fig.11

Fig.10
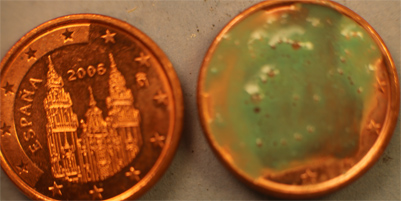
Fig.9