
Fig.1
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
ÁCIDO NÍTRICO CONCENTRADO Y MONEDAS I
Siguiendo la reacción de monedas españolas con oxidantes, ahora veremos
la acción del ácido nítrico
1. Ácido nítrico
concentrado y moneda española de una
peseta de peseta de 1988
(Composición 1,2g
de Al)
Trabajando como en prácticas anteriores, con una gota de HNO3 concentrado(fig.1), casi no reacciona,
solo lentamente sobre la cara, que en principio se oscurece y
después se destruye el relieve en la cara sumergida en el oxidante (Fig.2-5).

Fig.1

Fig.2 (ampliación)
El proceso redox que tiene lugar es:
REDUCC: 6HNO3 +6e
= 6NO2 +6O2-+6H+
OXIDAC: 2Al - 6e = 2Al3+
____________________________________
6HNO3 +2Al= Al2O3+
3H2O+ NO2
2.Ácido nítrico y moneda española de una peseta de
peseta de 1966
(Composición : 81-63%
cobre, 9-27% estaño, 10% aluminio)
Trabajando como en prácticas anteriores, con una gota de HNO3, reacciona rápidamente por su cara(fig.6-10), produciéndose numerosas burbujas de gas (NO2 y NO) así como el nitrato de cobre(II) verdoso, y nitrato de estaño amarillento.

Fig.5

Fig.6

Fig.10

Fig.3

Fig.4

Fig.7
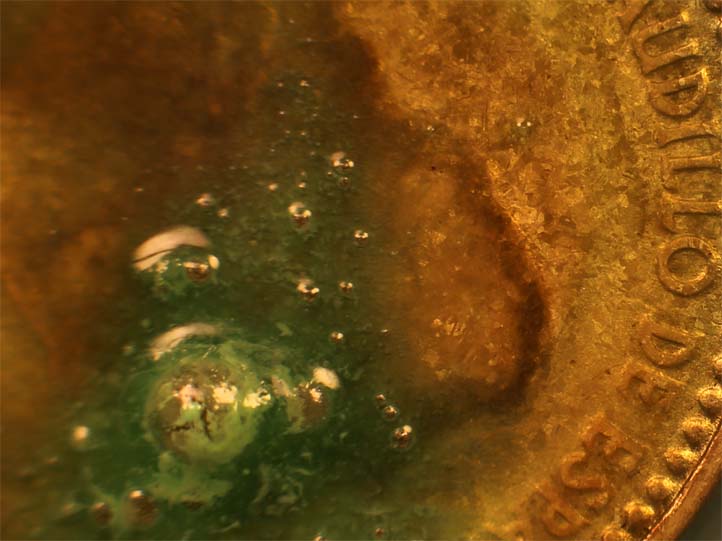
Fig.8

Fig.9
Los procesos redox que
tienen lugar son:
REDUCC: 4HNO3 + 2e-
= 2NO2 + 2H2O + 2NO3 -
OXIDAC: Cu - 2e = Cu2+
____________________________________________
4HNO3 +Cu = Cu(NO3)2 + NO2 (gas) + 2H2O
REDUCC: 8HNO3 + 6e- = 2NO + 4H2O + 6NO3 -
OXIDAC: 3Cu - 6e- = 3Cu2+
_________________________________________________
8HNO3 +3Cu = 3Cu(NO3)2 +
2NO (gas) + 4H2O
La masa blanco amarillenta (fig.10) se debe a la reacción con el Sn:
REDUCC: 4H++4HNO3 + 4e- = 4NO2 + 4H2O
OXIDAC: 2H2O+ Sn - 4e = SnO2+
_____________________________________
4HNO3 +Sn = SnO2(precipitado blanco) + 4NO2 (g)+ 2H2O