
Fig.1
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
DICROMATO POTÁSICO Y MONEDAS II
Siguiendo la reacción de monedas españolas con oxidantes, ahora veremos
la acción del dicromato potásico
2.Dicromato potásico
diluido y moneda española de una peseta de peseta de 1966
(Composición : 81-63%
cobre, 9-27% estaño, 10% aluminio)
Trabajando como en prácticas anteriores, con una gota de K2Cr2O7 (fig.1), reacciona lentamente por sus bordes(fig.2-5), después sobre la cara, destruyéndose el relieve en la cara sumergida en el oxidante (Fig.6). Al agregar una gota de ácido clorhídrico diluido para activar el oxidante, el metal reacciona violentamente (fig.7-11), con desprendimiento de hidrógeno, produciéndose sal de cromo (III) verdosa.

Fig.1

Fig.2

Fig.3

Fig.4

Fig.5
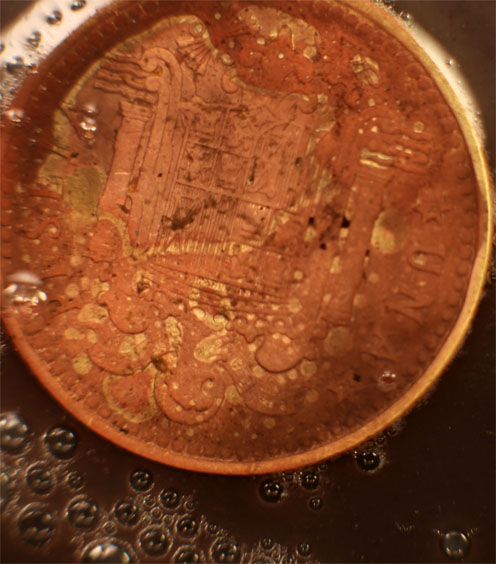
Fig.6( la otra cara de la moneda)

Fig.7(ampliación)

Fig.8
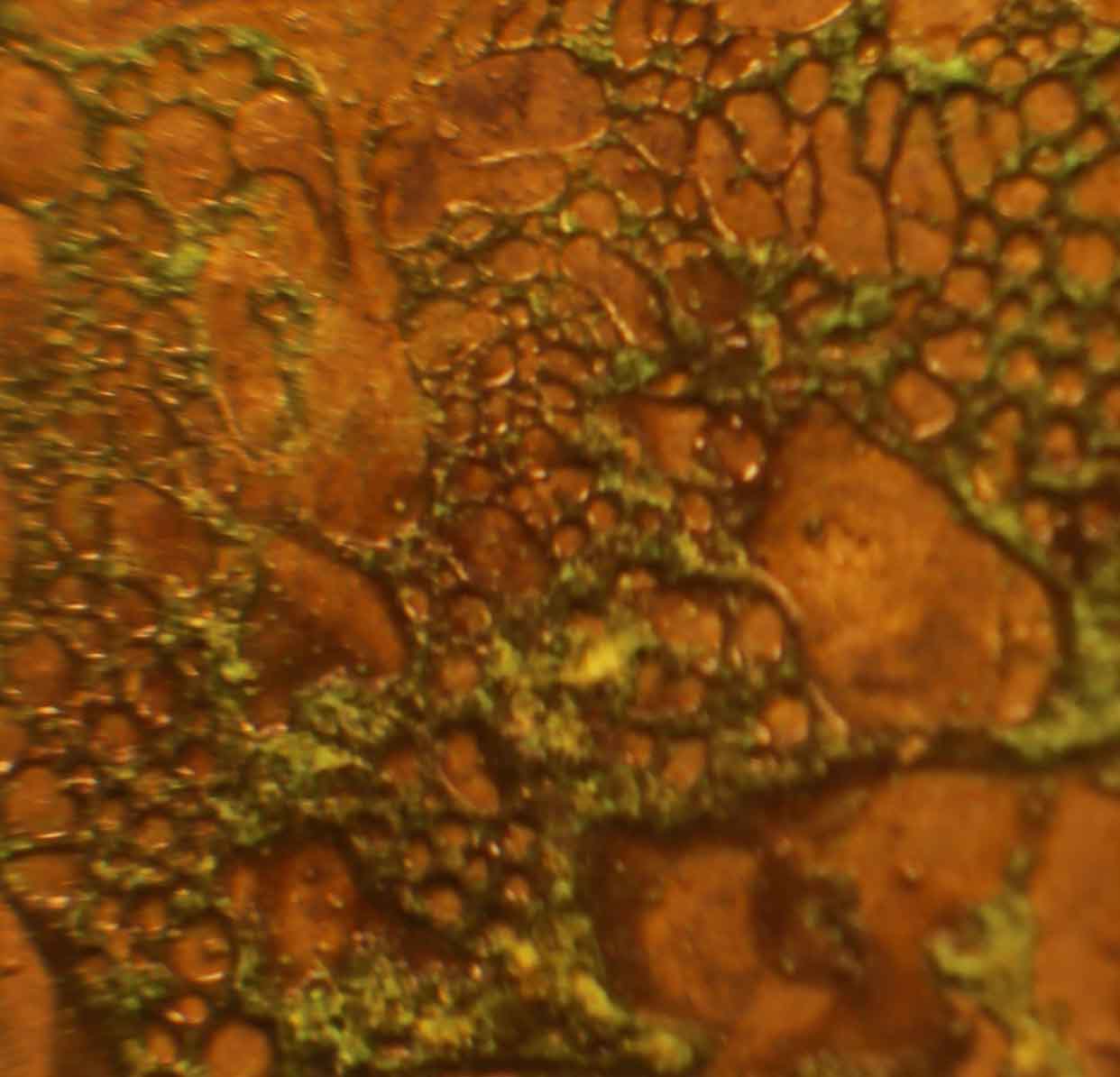
Fig.9 (ampliación)

Fig.10 (detalle de la otra cara)
Los procesos redox que
tienen lugar son:
REDUCC: K2Cr2O7 +14HCl+6e
= 2Cr3++2K++14H+ +7O2-+14Cl-
OXIDAC: 2Al - 6e = 2Al3+
________________________________________________
K2Cr2O7 +2Cu= 2AlCl3+ 7H2O+
2CrCl3 +2KCl
REDUCC: K2Cr2O7 +14HCl+6e
= 2Cr3++2K++14H+ +7O2-+14Cl-
OXIDAC: 3Cu - 6e = 3Cu2+
________________________________________________
K2Cr2O7 +2Cu= 2AlCl3+ 7H2O+
3CuCl2 +2KCl
REDUCC: 2HCl+2e = 2Cl-+H2
OXIDAC: Cu - 2e = Cu2+
________________________________________________
2HCl +Cu= CuCl2+ H2 ( burbujas)
También se produce con el tiempo una reacción
de adición
CO2+Cu2++O2- = CuCO3
Sin embargo con el tiempo se va
a producir otra reacción, entre el cobre en forma de óxido y el CO2 atmosférico formándose carbonato de cobre verdoso sobre la superficie de la
moneda, tanto en una cara como en la contraria (figs.8-10)