
Fig.1
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
PERMANGANATO POTÁSICO Y MONEDAS II
3. Permanganato potásico y moneda española de 5
céntimos de peseta de 1945 (99%Al)
Trabajando como en prácticas anteriores, con una gota de KMnO4 (fig.1), reacciona atacándose el grabado y produciéndose dióxido de manganeso marrón (fig.2 a 4), formándose en su superficie una costra que se va cayendo (fig.5-7)

Fig.1

Fig.2
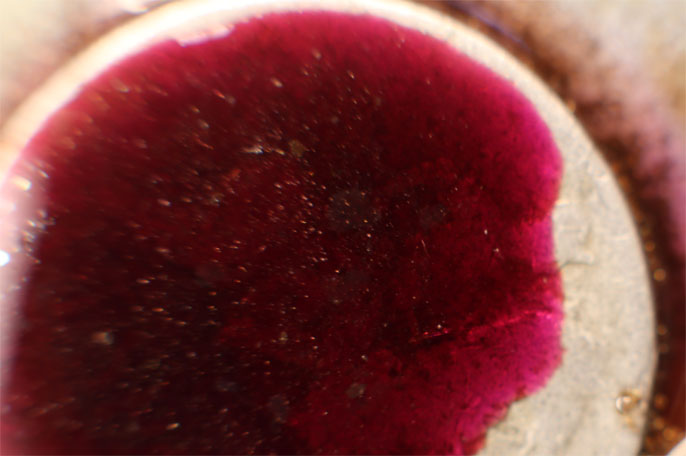
Fig.3

Fig.16

Fig.15 (ampliación)
Salvo en el primer caso (Composición 99% de Al), las demás reacciones son similares a las justificadas en el QG-78, puesto que el componente fundamental es el Cu.

Fig.4

Fig.14

Fig.12

Fig.10
5. Permanganato
potásico y moneda española de 1 peseta
de 1975 (Cu-Ni)
Trabajando como
en prácticas anteriores, con una gota de KMnO4(fig.11) sobre la moneda,
observamos que no reacciona ( fig.12-14). Sin embargo al cabo de un par de horas se observa en la ampliación, que cl grabado va desapareciendo (fig.15-16).

Fig.9

Fig.5 (detalle)

Fig.6(detalle)

Fig.13
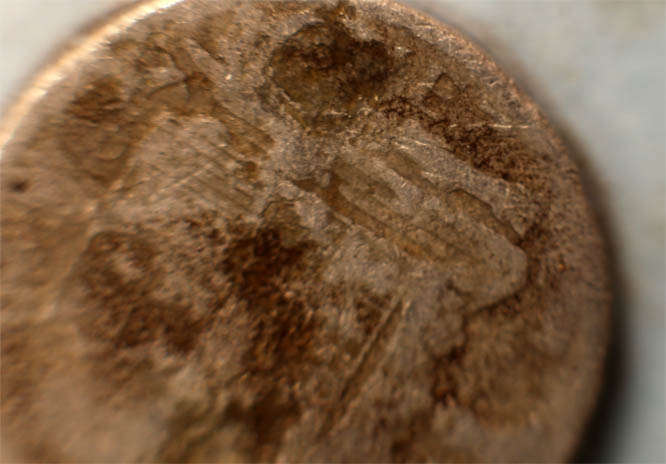
Fig.7

Fig.8
4. Permanganato potásico y moneda de 1959 de una peseta (Al-bronce) (81,63%Cu-9,27%Sn-10%Al)
Dado que el componente fundamental de la moneda es el aluminio, la reacción redox es parecida a la formulada en química a la gota, anterior (apartado 1).
REDUCC: 2KMnO4 + 6e- = 2MnO2 + 2K++4O2-
OXIDAC: 2Al - 6e = 2Al3+
______________________________________________
2KMnO4+2Al = K2O+ 2MnO2 +Al2O3