
Fig.1
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
PERMANGANATO POTÁSICO Y MONEDAS I
Hasta ahora hemos visto el comportamiento de diferentes monedas
españolas, frente a los ácidos y las bases fuertes mas conocidas. Ahora vamos a visualizar frente a un poderoso oxidante como el permanganato potásico.
1.Permanganato
potásico diluido y moneda española de una peseta de peseta de 1990
Trabajando como en prácticas anteriores, con una gota de KMnO4 (fig.1), reacciona lentamente por sus bordes; después sobre la cara, destruyendo el relieve con (fig.3-4), formándose MnO2, marrón (fig.5-6). La moneda es de cuproníquel, lo que explicaría la destrucción del relieve.

Fig.1

Fig.2

F ig.3
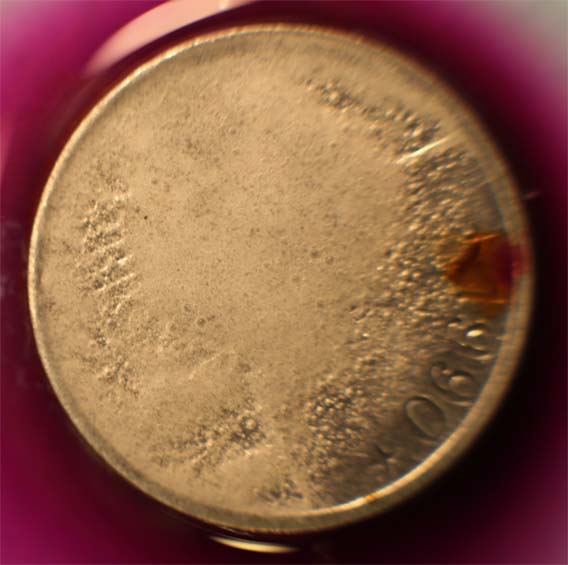
Fig.4

Fig.5

Fig.6

Fig.9

Fig.10
2. Permanganato potásico sobre moneda de una peseta de 1982.
Mientras que em la moneda anterior, el producto de la reacción era el dióxido de manganeso marrón, en este caso se forma también cromato potásico verde. La moneda es de cobre. Se opera como en casos anteriores y enseguida comienza a formarse el manganato potásico verde (fig.10) y por fuera de la moneda el dióxido de manganeso marrón oscuro (fig.11).

Fig.7

Fig.11

Fig.8
Como se observa los procesos químicos que justifican las formación de los productos resultantes, en el primer caso dióxido de manganeso (marrón oscuro) y en el segundo, el manganato potásico (verde) y dióxido de manganeso , serían los siguientes:
REDUCC: 2KMnO4 + 6e- = 2MnO2+ K2O+3O2-
OXIDAC: 2Ni - 6e = 2Ni3+
______________________________________________
2KMnO4 +2Ni= 2MnO2+ K2O+ Ni2O3
REDUCC: 2KMnO4 + 4e- = K2MnO4+ MnO2+2O2-
OXIDAC: 2Cu - 4e = 2Cu2+
______________________________________________
2KMnO4 +2Cu= K2MnO4+ MnO2+ 2CuO

Fig.12