ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
Los
desplazamientos de equilibrio con la transferencia de energía. Termómetros
químicos.
Muchos de los intercambios de ligandos en la
formación de complejos ocurren con absorción o desprendimiento de energía.
Los más característicos son los estudiados a continuación, ya que dichos
compuestos puedan usarse como verdaderos termómetros químicos.
1. Los complejos de cobalto(II)
Uno de los ejemplos mas conocidos, es el cloruro
de hexaacuocobalto(II), hexaédrico, de color rosa pálido que por calefacción
se transforma en un complejo tetraédrico distorsionado, intercambiado
los ligandos agua por cloro, tomando color azul. Este caso es el empleado
en la tinta invisible (el rosa pálido casi no se percibe, mientras que
el azul destaca bastante).
Q+ Co(H2O)6 2+
+ 2Cl- ![]() [Co(H2O)2Cl2]
+ 4H2O
[Co(H2O)2Cl2]
+ 4H2O
En exceso de iones Cl-, como ocurre
en este caso, el proceso continúa
Q+ [Co(H2O)2Cl2]
+ 2Cl- ![]() [CoCl4]2-
+ 2H2O
[CoCl4]2-
+ 2H2O
De forma
que
CalentandoºAzul Enfriando o agregando agua ºRosa pálido
Q aproximadamente se encuentra entre 42 y 54
kJ/mol. El complejo hexaédrico, presenta un pico de absorción en los 550nm,
mientras que en el tetraédrico el pico más definido aparece a los
675 nm, aproximadamente, finalmente el complejo tetraclorocobalto(II),
presenta un pico de absorción a los 650nm (color azul oscuro)
En el montaje que se realiza para fotografía
digital, se sitúa en la caja Petri, unos cristalitos de cloruro de cobalto(II),
una gota de agua destilada y unos cristalitos de cloruro sódico, tal como
se aprecia en las figura 1. Se disuelve el cloruro de cobalto, formándose
el complejo hexaacuocobalto(II) (fig. 2), de
color rosa, y posteriormente se disuelve el cloruro sódico (fig. 3), sin
que cambie de color.

fig. 1
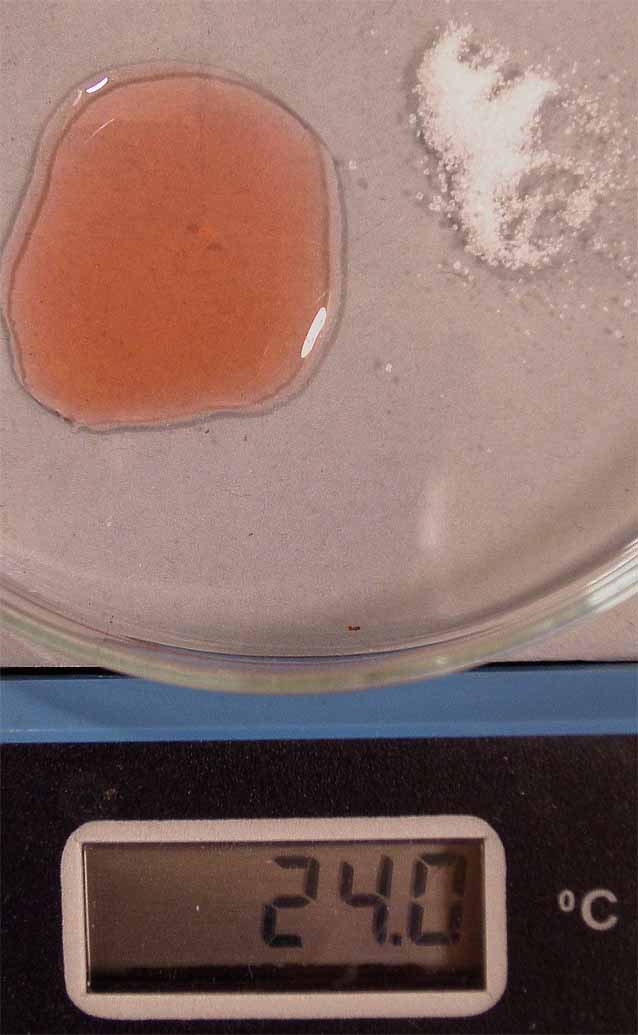
fig. 2
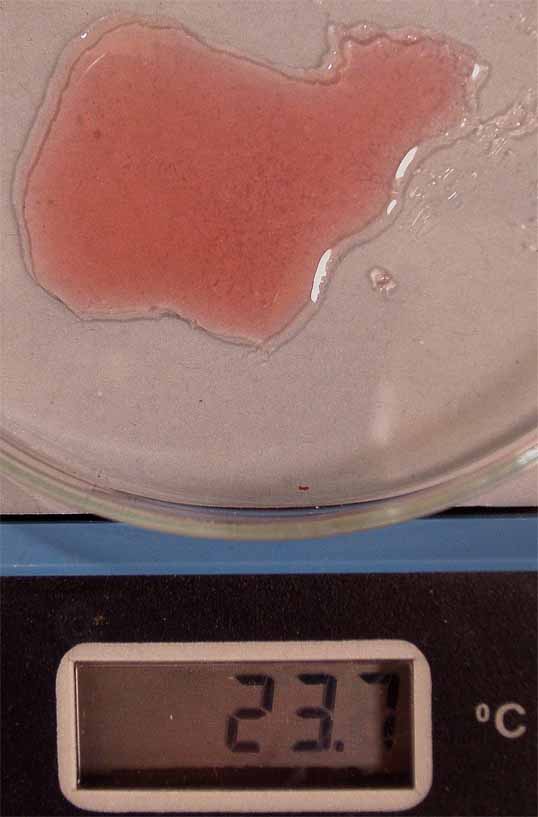
fig. 3
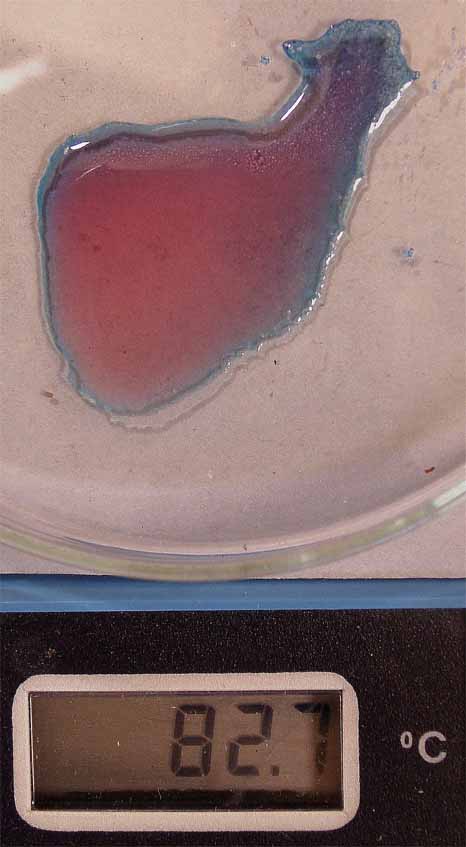
fig. 4
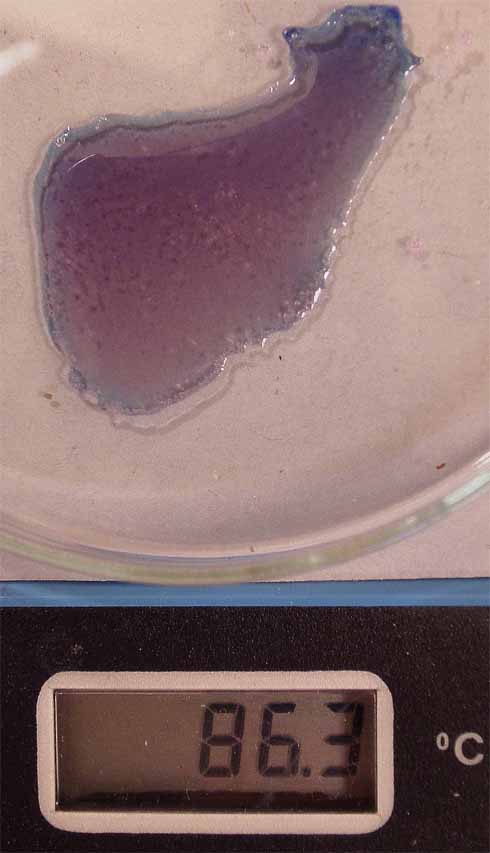
fig. 5
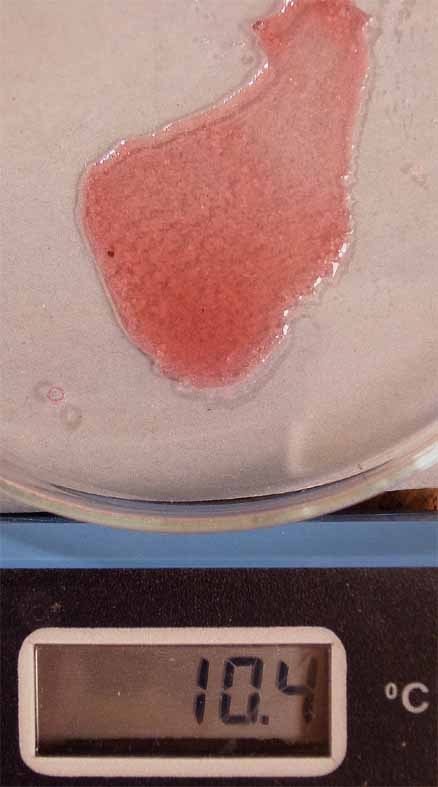
fig. 6
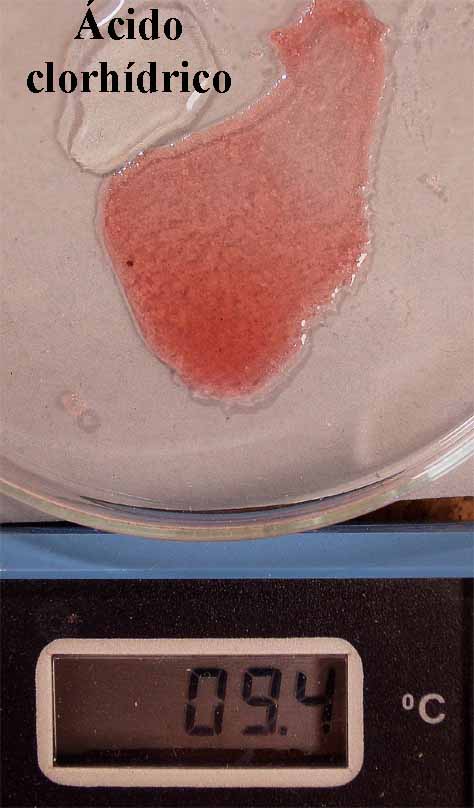
fig. 7
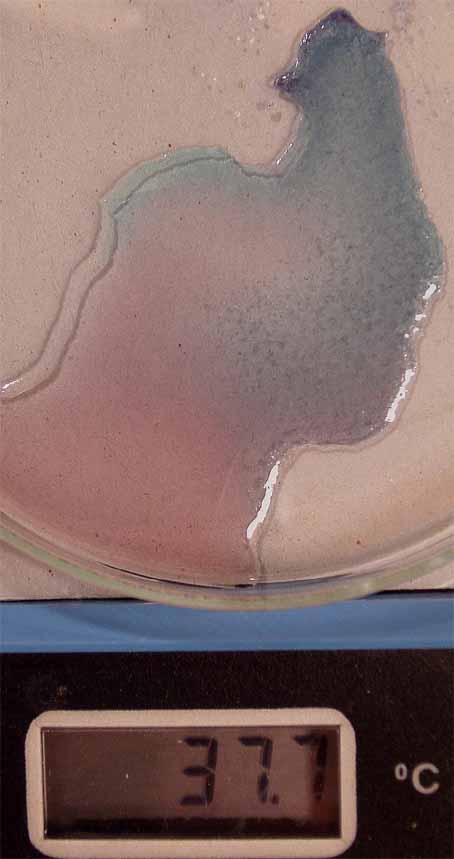
fig. 8

fig. 9
2. Los complejos de cobre(II).
Los complejos de cobre aunque menos vistosos
que los de cobalto también se pueden desplazar mediante intercambio de
calor.
El
cloruro de cobre (II), forma complejos tetraédricos con el agua, que en
un proceso endotérmico puede ser intercambiada con bromo, al reaccionar
con bromuro potásico, dando complejos verdosos, con un cierto tono rojizo
(por formación de bromo). La reacción puede completarse haciéndola reaccionar con hidróxido amónico,
con lo que formará complejos amoniacales de color azul más oscuro.
Q + [Cu(H2O)4]2+
+ 4Br- ![]() [
CuBr4]2- + 4H2O
[
CuBr4]2- + 4H2O
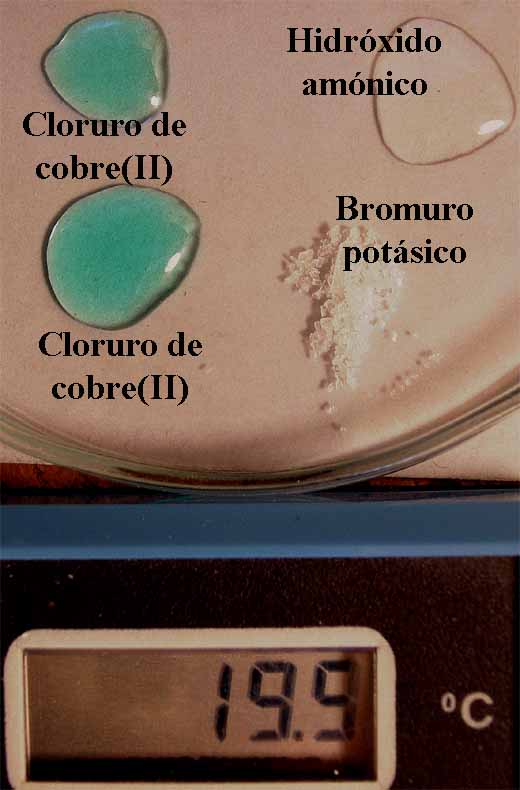
fig. 10
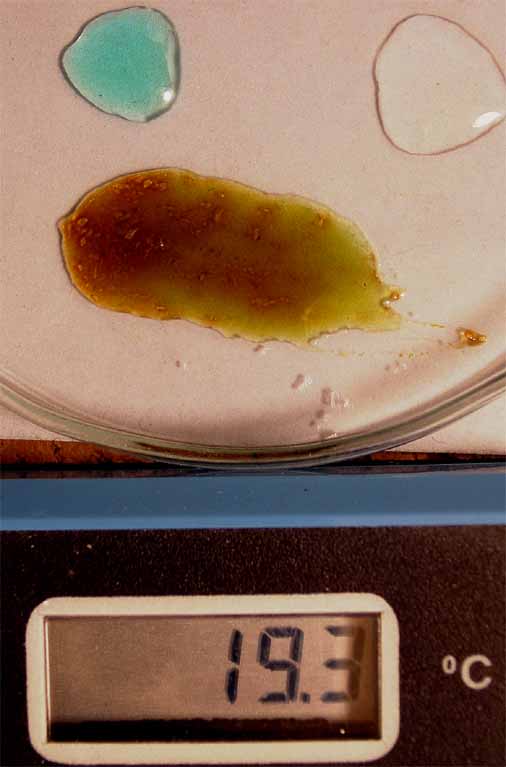
fig. 11

fig.12

fig. 14
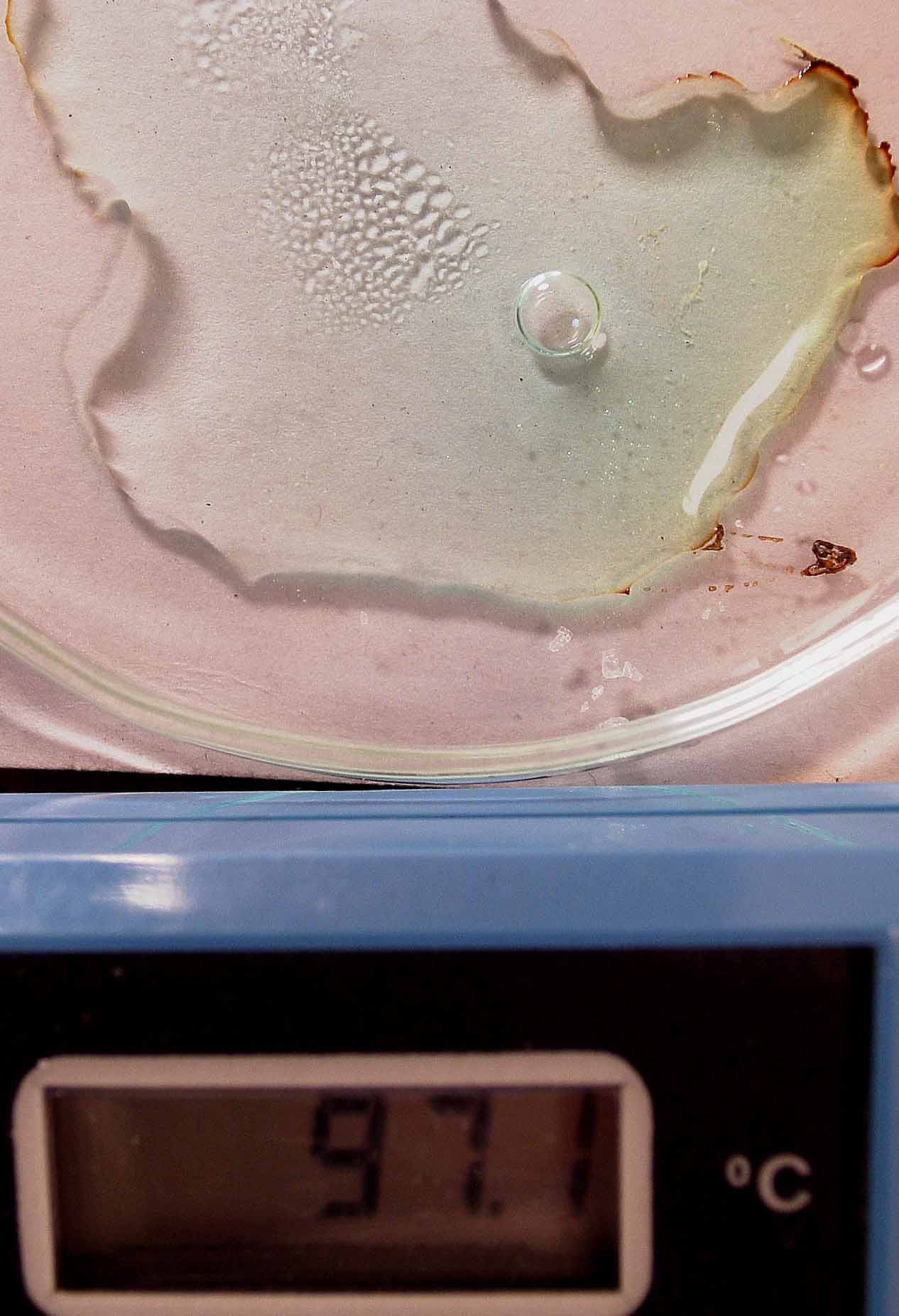
fig. 13
En la 14 se conserva el cloruro de cobre(II) original para observar mejor su color en
comparación con el obtenido.
3. Los complejos de cromo(III).
Los complejos de cromo(III),
tal como los de cobalto(II) y cobre (II), también sufren desplazamientos
por acción de calor, con intercambio de ligandos
y por lo tanto con cambios de color, que los convierten en verdaderos
termómetros químicos.
Se va a hacer reaccionar nitrato de cromo(III), con cloruro sódico. Para lo cual en una caja Petri se disponen tal como indica la figura 15. Nitrato de cromo (III) sólido, una gota de agua destilada, y cloruro sódico sólido. Se disuelve el nitrato de cromo (III) en el agua (fig. 16), observándose el color púrpura característico. Después se disuelve el cloruro sódico, sin que se aprecie cambio de color alguno (fig. 17). Prácticamente la temperatura no ha variado.

fig. 15

fig. 16
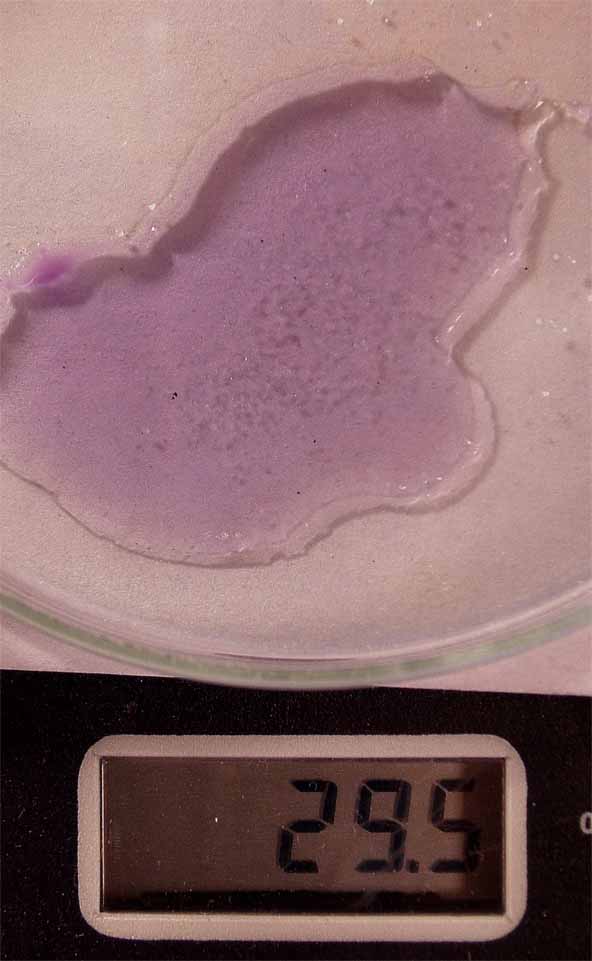
fig. 17

fig. 18

fig. 19

fig. 20
La justificación
de estos procesos, está en el intercambio de ligandos
acuo por cloro, favorecidos por el calentamiento
del sistema. Este intercambio de ligandos, tal
como se ha explicado en Equilibrio Químico I, modifica la energía de desdoblamiento,
alterando la absorción energética, y cambiando el color de compuesto.
Ahora bien dado que es un equilibrio, el color resultante dependerá de
la composición de la mezcla en equilibrio, según predomine una forma o
la otra. Por eso los cambios no resultan especialmente llamativos y los
colores de la mezcla no son muy definidos.
Los procesos químicos serían:
Q+ Cr(H2O)6 3+ +
2Cl- ![]() [Cr(H2O)4Cl2]1+
+ 2H2O
[Cr(H2O)4Cl2]1+
+ 2H2O