
Fig.1
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
ÁCIDO ORTOFOSFÓRICO Y METALES (IV)
1.Ácido ortofosfórico 14M y estaño
Trabajando como en prácticas anteriores, con una gota de ácido ortofosfórico 14M, inicialmente parece que no reacciona (fig.1), pero al cabo de unos pocos minutos la reacción es fundamentalmente superficial (fig. 2), atacándose la lámina (fig.3), formándose en su superficie ortofosfato de estaño (fig.4- 7) insoluble de color blanco grisáceo. No se aprecia el desprendimiento de hidrógeno, sólo superficialmente en las últimas fotos.

Fig.1

Fig.3

Fig.2
Las reacciones químicas que se producen son redox
REDUCC: 2H3PO4 + 6e- = 3H2 + 2PO4 3-
OXIDAC: 3Pb - 6e = 3Pb2+
______________________________________________
2H3PO4 +3Pb= 3H2(gas)+
Pb3(PO4)2
REDUCC: H3PO4 + 2e- = H2 + HPO4 2-
OXIDAC: Pb - 2e = Pb2+
______________________________________________
H3PO4 +Pb = H2(gas)+ PbHPO4

Fig.8
2. Ácido ortofosfórico 14M y granallas de plomo
En este caso si se produce reacción visible con desprendimiento de hidrógeno gas al cabo de escasos minutos(fig.8-12)
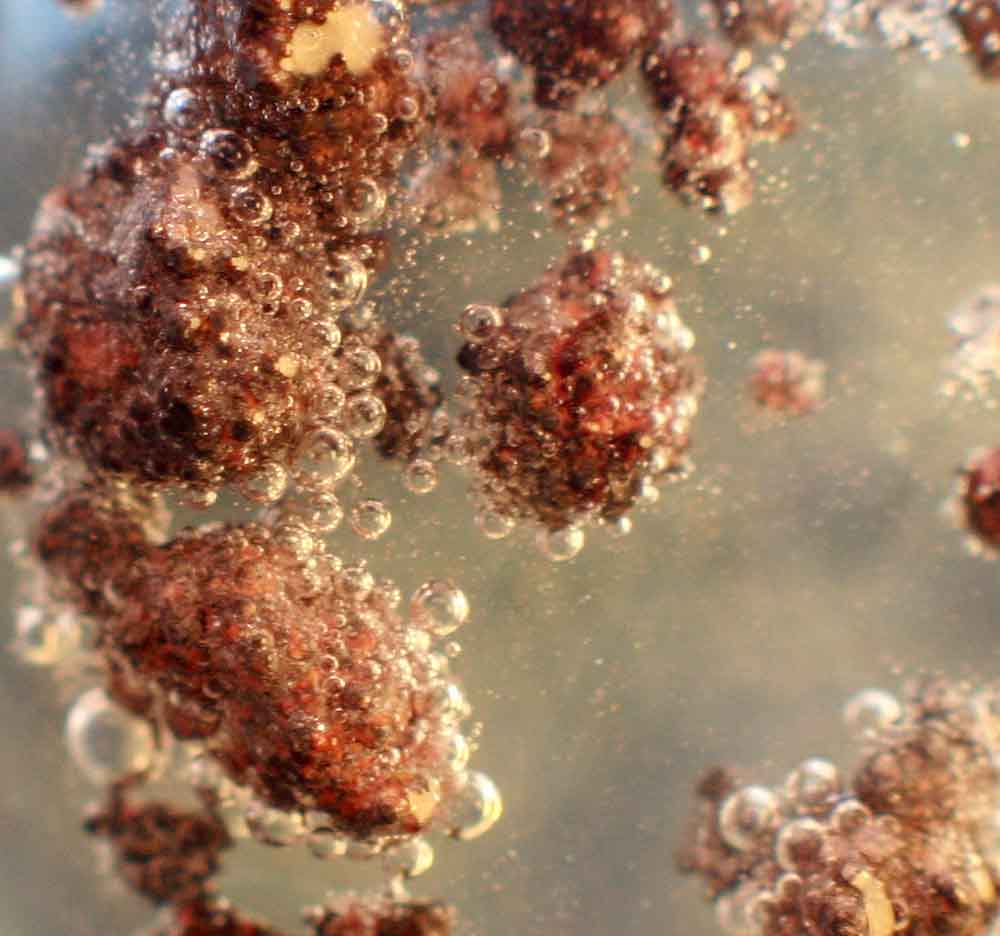
Fig.10 (ampliación)

Fig.7

Fig.9

Fig.4
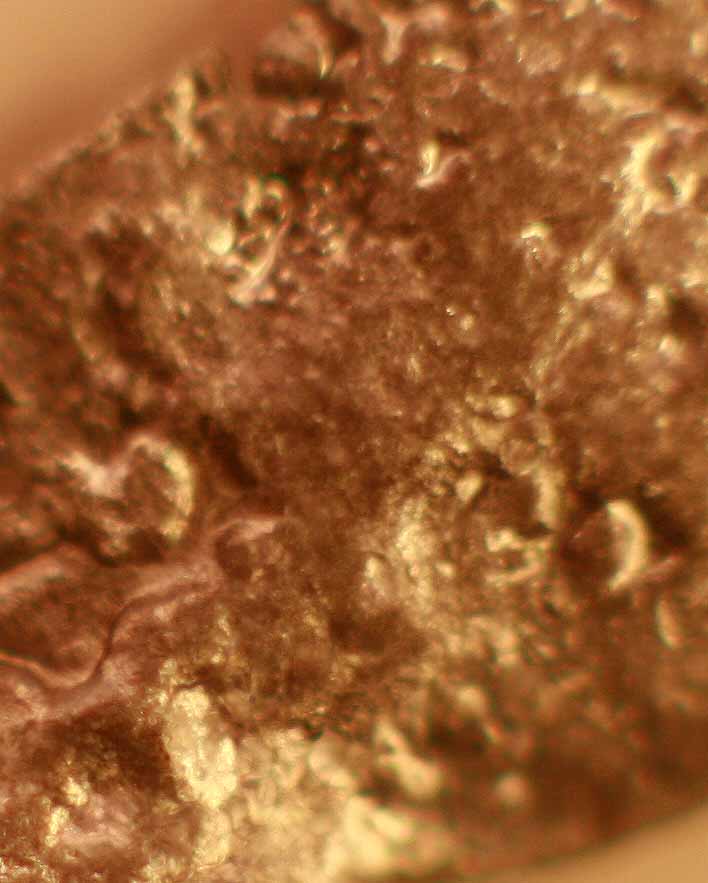
Fig.5 (detalle)

Fig.11 (detalle)

Fig.6
Las reacciones químicas que se producen son redox
REDUCC: 2H3PO4 + 6e- = 3H2 + 2PO4 3-
OXIDAC: 3Sn - 6e = 3Sn2+
______________________________________________
2H3PO4 +3Sn = 3H2(gas)+
Sn3(PO4)2
REDUCC: 6H3PO4 + 6e- = 3H2 + 6H2PO4 1-
OXIDAC: 3Sn - 6e = 3Sn2+
______________________________________________
6H3PO4 +3Sn = 3H2(gas)+
3Sn(H2PO4)2