
Fig.1
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
ÁCIDO ORTOFOSFÓRICO Y METALES (III)
1.Ácido ortofosfórico 14M y cinc
Trabajando como en prácticas anteriores, con una gota de ácido ortofosfórico 14M, y una pequeña lámina de Zn, de 1 cm2, inicialmente parece que no reacciona (fig.1), pero al cabo de unos pocos minutos la reacción es comienza a mostrarse por los bordes de la lámina (fig. 2), con desprendimiento de hidrógeno en forma de pequeñas burbujitas, que al cabo de 5 minutos se hacen más grandes (fig.3 y 4), formándose ortofosfato de cinc (fig.5 y 6) insoluble, y también dihidrógeno ortofosfato de cinc,algo soluble.

Fig.1

Fig.2
Las reacciones químicas que se producen son redox
REDUCC: 2H3PO4 + 6e- = 3H2 + 2PO4 3-
OXIDAC: 3Zn - 6e = 2Zn2+
________________________________________
2H3PO4 +2Zn = 3H2(gas)+
Zn3(PO4)2
REDUCC: 6H3PO4 + 6e- = 3H2 + 6H2PO4 1-
OXIDAC: 3Zn - 6e = 3Zn2+
______________________________________
6H3PO4 +2Zn= 3H2(gas)+
3Zn(H2PO4)2
El residuo insoluble se queda sobre la lámina ( fig.7 y 8)

Fig.3
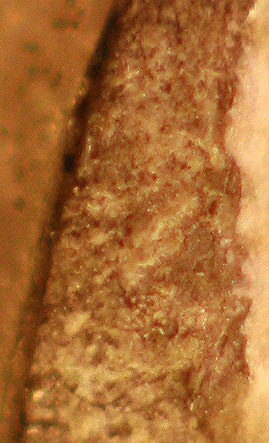
Fig.7(detalle)
Las burbujas de hidrógeno, siguen produciéndose media hora después de iniciada la reacción, incluso sobre la lámina de cinc (fig 9 y 10).

Fig.9
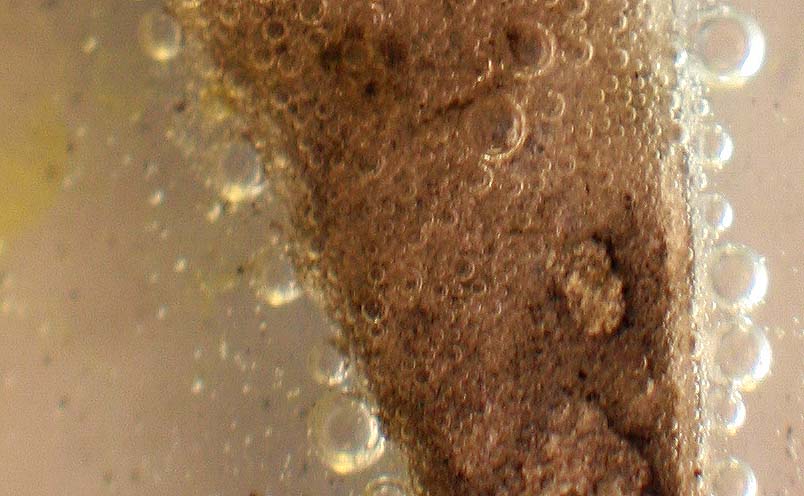
Fig.10 (ampliación)

Fig.4 (detalle)

Fig.6

Fig.8

Fig.5