
Fig.6
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
ÁCIDO ORTOFOSFÓRICO
Y METALES (I)
1.Ácido ortofosfórico
14M y granalla de aluminio
Trabajando como en prácticas anteriores, con una gota de ácido ortofosfórico 14M, inicialmente parece que no reacciona (fig.1), pero al cabo de unos pocos minutos la reacción es muy violenta (fig. 2), atacándose las granallas, con desprendimiento de hidrógeno de forma espectacular (fig.3), formándose ortofosfato de aluminio (fig.4 y 5) insoluble, y también dihidrógeno ortofosfato de aluminio, muy soluble.
Las reacciones químicas que se producen son redox
REDUCC: 2H3PO4 + 6e- = 3H2 + 2PO4 3-
OXIDAC: 2Al - 6e =
2Al3+
______________________________________________
2H3PO4
+2Al = 3H2(gas)+ 2AlPO4
REDUCC: 6H3PO4 + 6e- = 3H2 + 6H2PO4
1-
OXIDAC: 2Al - 6e =
2Al3+
______________________________________________
6H3PO4
+2Al = 3H2(gas)+ 2Al(H2PO4)3
2. Ácido ortofosfórico 14M e hilo de cobre
En este caso no se produce reacción
visible (fig.6 y 7)

Fig.6

Fig.7
3. Ácido ortofosfórico 14M y granalla de hierro.
Se opera de la misma forma que en casos
anteriores (fig.8) observándose rápidamente la reacción con desprendimiento
de hidrógeno(fig.9) y formación de ortofosfato férrico amarillento (fig.10
y 11).
Las reacciones químicas que se producen son redox
REDUCC: 2H3PO4 + 6e- = 3H2 + 2PO4 3-
OXIDAC: 2Fe - 6e =
2Fe3+
______________________________________________
2H3PO4
+2Al = 3H2(gas)+ 2FePO4

Fig.8

Fig.9
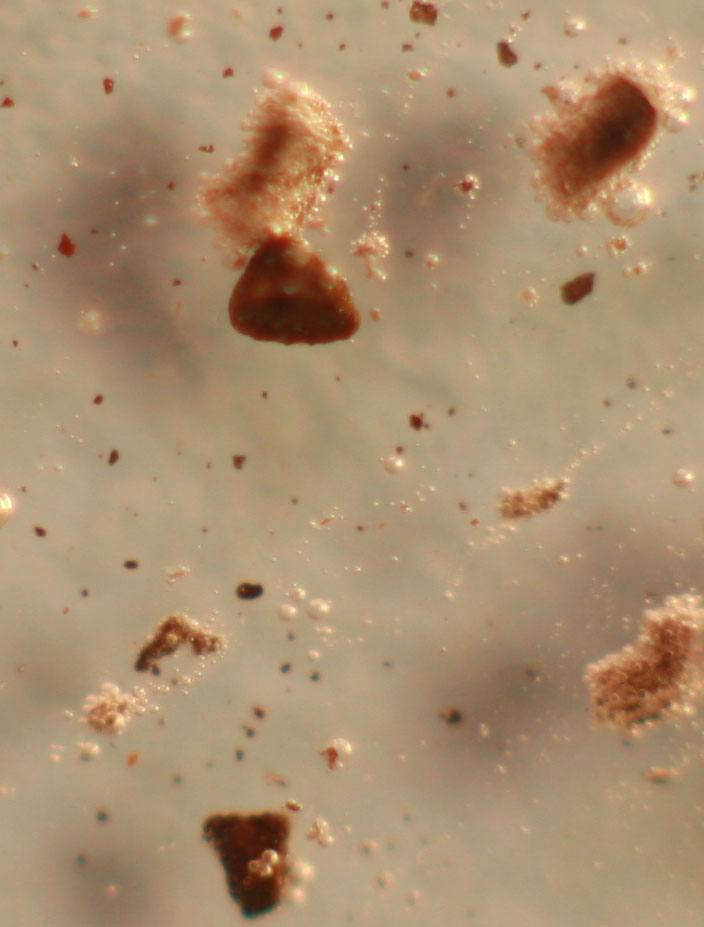
Fig.10
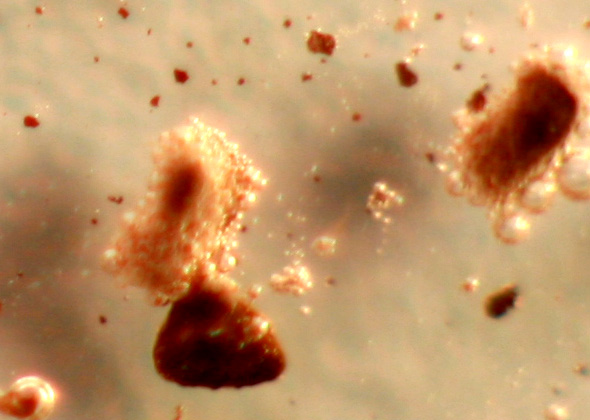
Fig.11 (detalle)
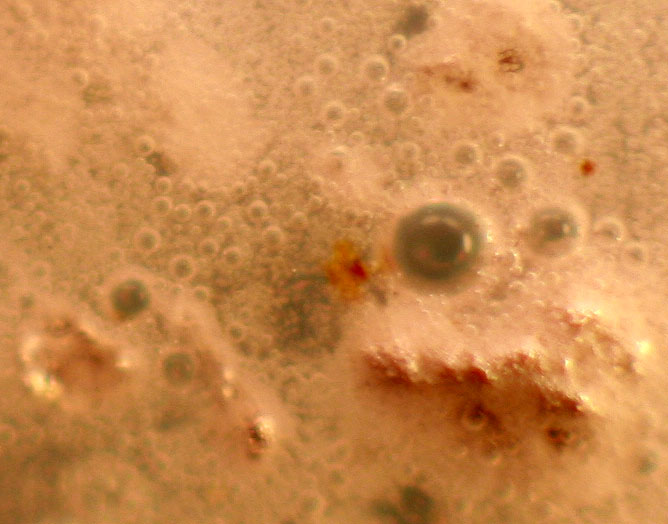
Fig.5(Detalle
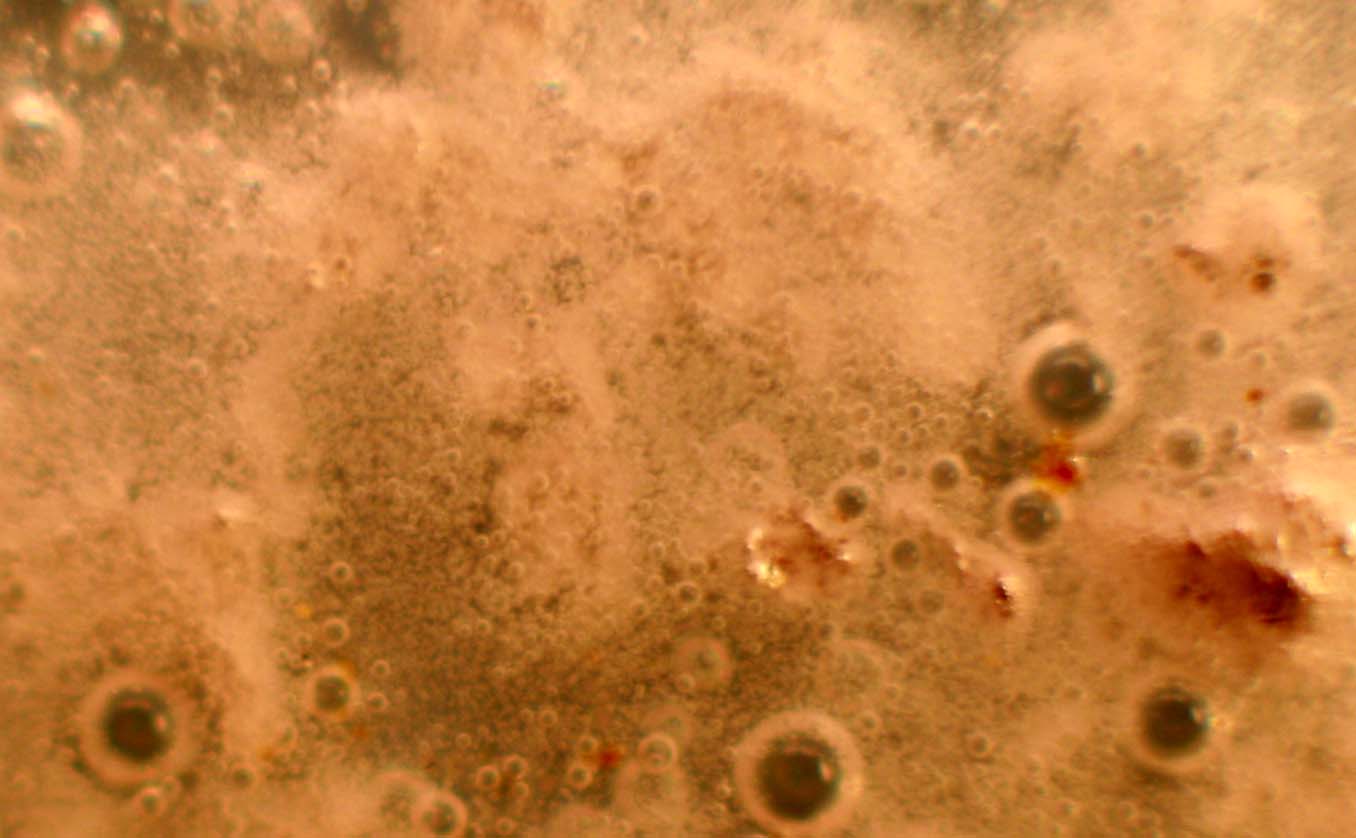 Fig.4
Fig.4

Fig.1
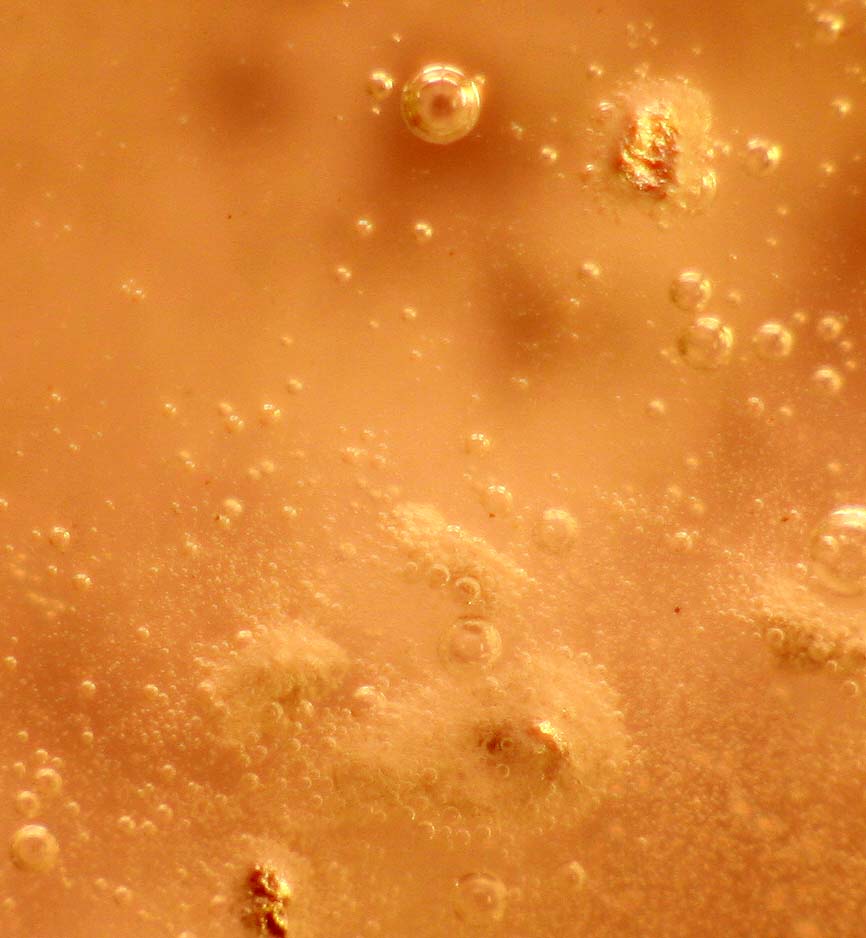
Fig.2
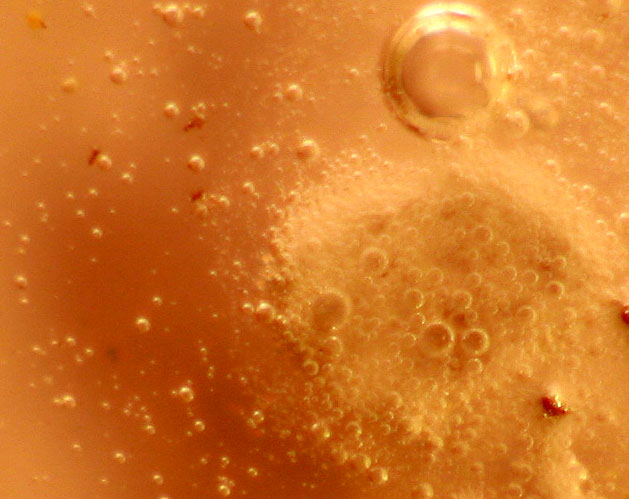
Fig.3