
Fig.7
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
ÁCIDO CLORHÍDRICO
Y COBRE (SEGUNDA PARTE)
3.Ácido clorhídrico
1,1M e hilo de cobre
Con ácido clorhídrico 1,1M, inicialmente
no reacciona (fig.7). Al cabo de 10
minutos la reacción es muy débil (fig
8), atacándose el hilo de cobre, sin desprendimiento de hidrógeno (fig.9),
aunque se amplíe la imagen (fig.10 y 11).Al cabo de horas, se forma cloruro
de cobre(I) en disolución de color marrón (fig.10 y 11). Una vez que se ha
evaporado el disolvente y aparece el residuo blanco del CuCl (fig.12).

Fig.7

Fig.8
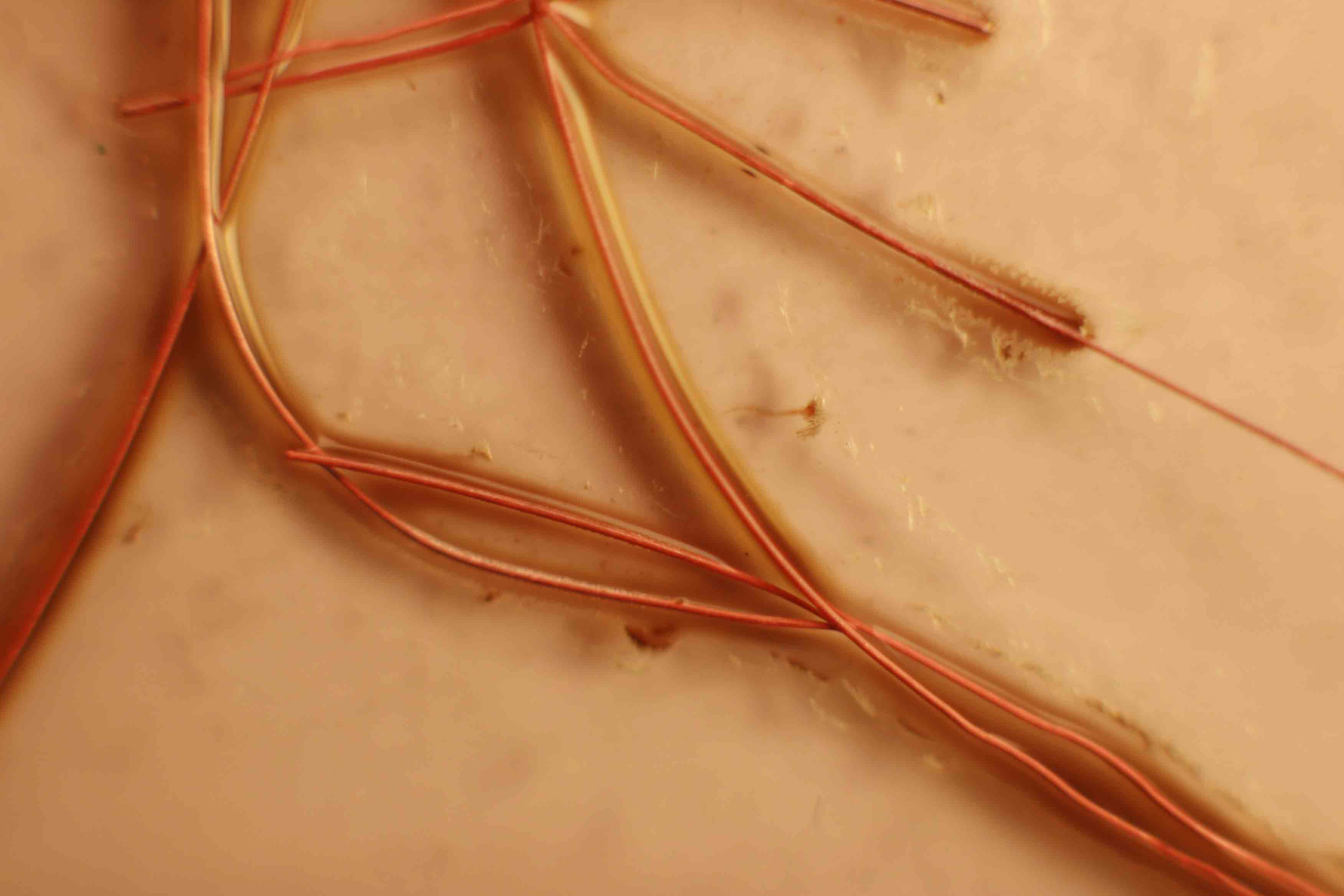
Fig.9

Fig10(ampliación)

Fig.11(ampliación)

Fig.12
4. Ácido clorhídrico 11M e hilo de cobre
En este caso
la reacción es más rápida (fig.13 y 14)

Fig.13

Fig.14
Una toma, se deseca rápidamente y se
sacan los hilos de cobre, observándose la formación del cloruro de cobre(I)
marrón (fig 15 y 16, detalle)
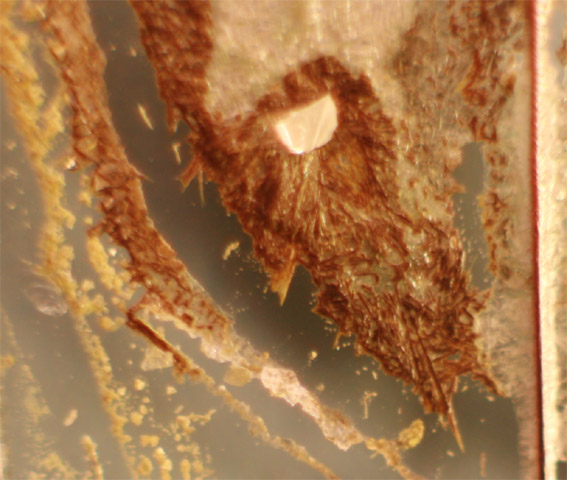
Fig.15
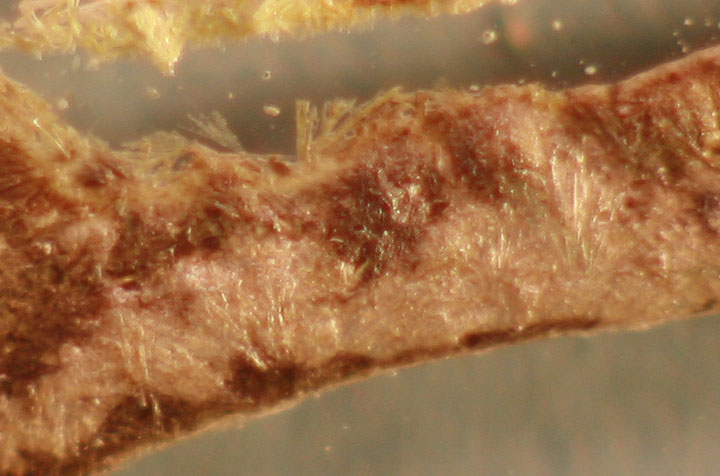
Fig.16 (detalle)
Al cabo de un tiempo se formará el cloruro de cobre(II) verdoso
(fig 17 y 18)

Fig.17

Fig.18
En otra toma, se dejó cristalizar lentamente, produciéndose los resultados observados en las fig 19 y 20.
Las reacciones químicas que las explican se han dado en la práctica anterior

Fig.19

Fig.20