ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
EQUILIBRIO QUÍMICO I
INTRODUCCIÓN
Dos años
antes de su muerte, Enrique de Le Chatelier fue nombrado en 1934, Doctor
Honoris Causae por la Universidad de Madrid, cincuenta años después de
que su famoso principio viera la
luz. Su mayor éxito fue la publicación en Comptes Rendus, el 10 de noviembre
de 1884, de las leyes que regulan las modificaciones de los equilibrios
químicos con el título ASur les lois de la disolution@, que completaban la ALey del equilibrio móvil A de Van=t Hoff,
de ese mismo año y la ley de Robín publicada cinco años antes,
y referida específicamente a la presión de sistemas en equilibrio
[1]
. Este principio postulaba que
un sistema en equilibrio sometido a una acción
capaz de deformarlo, experimentaba modificaciones que tendían a producir
una reacción semejante pero de sentido contrario a la acción a la que
había sido sometido, y recíprocamente
[2]
. Tres años después de este hecho leyó su tesis
doctoral. Durante sus cuarenta años de enseñanza de la Química en la Escuela
de Minas y en la Sorbonne parisina, dirigiría unas treinta.
Vamos
a tratar de estudiar a través de reacciones químicas a la gota, los factores
externos que modifican un equilibrio,
y cómo la reacción reversible
actúa en el sentido de contrarrestarlos.
1.UN
DESPLAZAMIENTO FÁCIL Y RÁPIDO: EL EQUILIBRIO CROMATO DICROMATO.
Es muy
conocido y empleado el desplazamiento del equilibrio ácido base cromato/dicromato,
porque resulta muy rápido, lo cual siempre se valora en una clase experimental,
para que los alumnos no se impacienten, presentando colores intensos que captan enseguida su atención.
Para
hacerlo, se disponen en una caja Petri, 4 gotas; una de una disolución
de cromato (amarillo), otra de dicromato
(anaranjado). Las otras dos de
hidróxido sódico 6N y de H2SO4
6N, tal como aparecen en la fotografía 1
Se unen
las gotas: dicromato potásico con hidróxido sódico y cromato potásico
con ácido sulfúrico y se aprecian los
fenómenos indicados en las fotos 2 y 3

foto 1
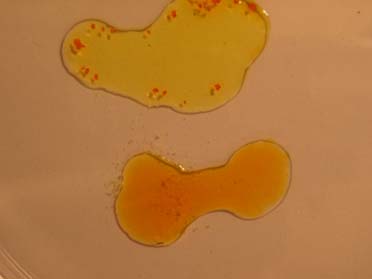
foto 3
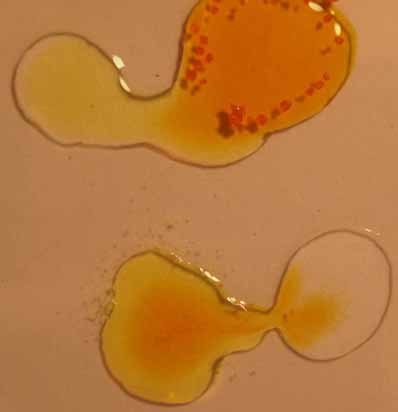
foto 2
Se han
empleado cristalitos de dicromato potásico en la disolución para reforzar
el color del dicromato, frente al cromato, dado que el naranja si es algo
débil puede confundirse con el amarillo.
La reacción
producida es:
Al agregar
protones sobre el cromato amarillo, el equilibrio se desplaza hacia la
izquierda formándose el dicromato naranja. De la misma forma, al añadir
OH-, sobre el dicromato naranja, el desplazamiento del equilibrio
hacia la derecha producirá el cromato amarillo. Por este motivo se intercambian
los colores de las gotas.
El origen
de la diferencia de colores está en la estructura de los propios iones:
el cromato es tetraédrico, mientras que dicromato, está formado por dos
tetraedros unidos por un puente de oxígeno. En este caso la distancia
Cr-O, es mayor (1,78D) frente los 1,61D, en
la unidad tetraédrica del cromato. Esta mayor separación, modifica la
interacción que se produce entre ellos y hace que la separación de las
bandas de valencia y conducción en el caso del sólido dicromato sea ligeramente menor que en el cromato; 2,6eV frente a 2,8eV.Debe
recordarse que tal como en el permanganato potásico, el desdoblamiento
se produce por una transición electrónica p-d, desde los electrones del
O2- al metal, por eso la modificación en las distancias afecta
al color.
En disolución no se forman complejos acuosos,
por lo que se conserva la estructura iónica discreta de los iones cromato
y dicromato. El dicromato presenta dos picos de absorción, a 380 y 450 o 22267cm-1(azul), mientras que
en el cromato la absorción predomina sobre los 380nm
o 26369cm-1 (en el
límite del violeta) (Véase la tabla de energías de desdoblamiento y colores),
lo que hace que el dicromato sea anaranjado, mientras que el cromato
es amarillo pálido (amarillo limón)
Tabla
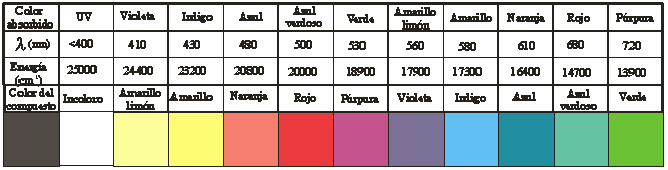
Nota:
En la tabla anterior los valores correspondientes
a cada radiación absorbida, o a las frecuencias correspondientes a cada
color están dadas por valores medios. En este
caso, el color amarillo corresponde
a absorción en el violeta que abarca aproximadamente desde 380 a 455nm,
mientras que el color naranja, corresponde a absorción en el azul, que
abarca aproximadamente entre 455
a 492nm.
2. EL DESPLAZAMIENTO DEL EQUILIBRIO
EN COMPLEJOS: EL CASO DEL SULFATO CÚPRICO.
El desplazamiento
de un equilibrio a través de la modificación de la concentración de los
reaccionantes, es muy fácil de conseguir a través del intercambio de ligandos
en compuestos complejos, pues como veremos, éstos al alterar la energía
de desdoblamiento, producen una modificación en el color a través de tránsitos
dd.
Se van a situar dos gotas de sulfato de cobre en una caja Petri, tal como indica la foto 4 (una de las gotas actuará como testigo de color). Junto a ellas unos cristalitos de cloruro sódico y otros de sulfato sódico. Se extiende la gota de sulfato de cobre (II), hasta casi disolver los cristales de cloruro de sodio (foto 5) (es necesario que para que el color verdoso se note exista gran concentración de cloruro sódico)
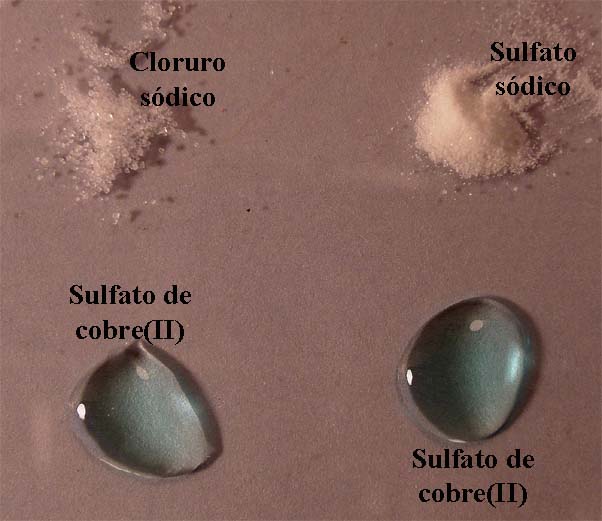
foto 4

foto 5
La primera
reacción se produce al disolverse
los cristales de cloruro sódico (foto 5) en el sulfato cúprico, observándose un cambio de color de azul muy
suave, a verde muy suave (los colores son poco intensos, y a veces se
hace difícil distinguirlos). El proceso es la
siguiente:
[Cu(H2O)4]2++4 NaCl(aq)![]() [CuCl4]2- + 4Na+ (aq)+ 4H2O
[CuCl4]2- + 4Na+ (aq)+ 4H2O
Al disolverse
los cristales de sulfato sódico, extendiendo la gota, otra vez se observa
el cambio de color a azul (foto 6), ello es debido a que el equilibro se desplaza
hacia la izquierda (dominando el azul) siguiendo el principio de Le Chatelier
Si ahora se añaden unas gotas de hidróxido amónico concentrado al sistema (foto 7), se forma un complejo amoniacal, intercambiándose los ligandos cloro (Cl-) por amoniaco (NH3), y volviendo el color azul, aunque algo más oscuro que el original del sulfato cúprico, dado que el complejo es diferente.
La reacción
sería:
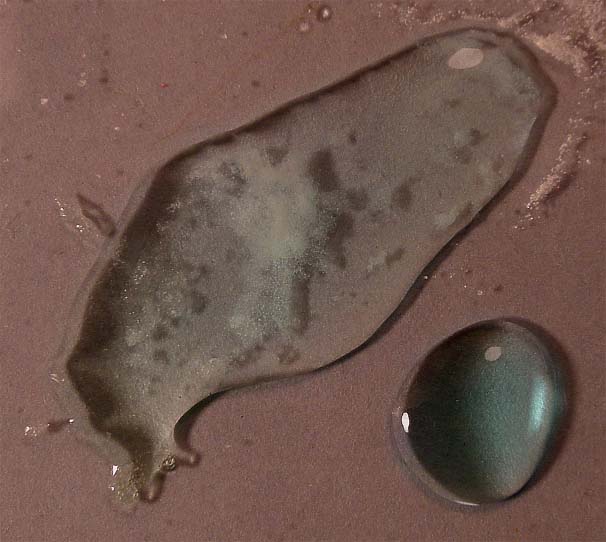
foto 6
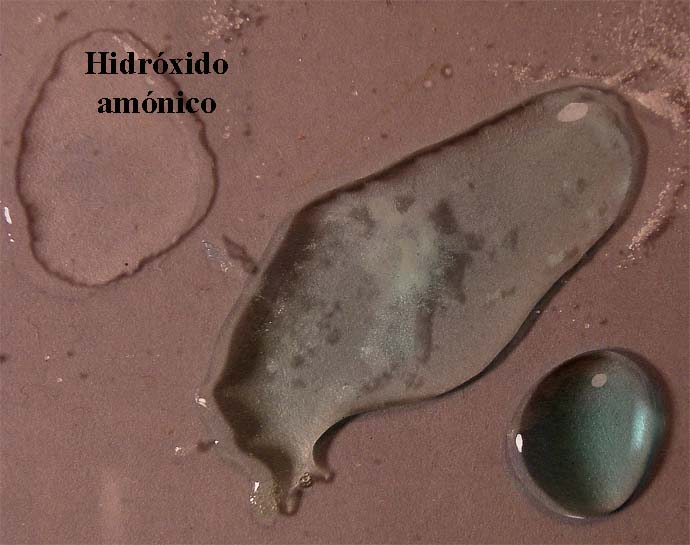
foto 7
El color
se hace mas intenso debido a que el ligando NH3,
favorece los tránsitos p-d.
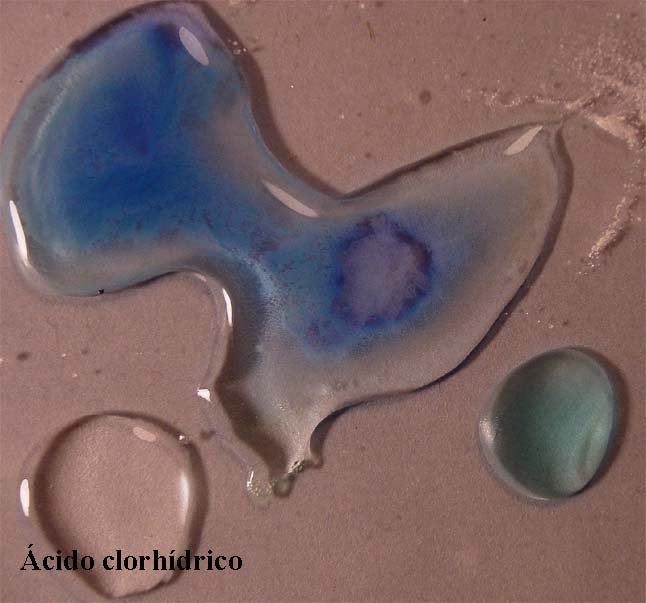
foto 8
Si ahora
se agregara ácido clorhídrico concentrado, el equilibrio se desplazaría
hacia la izquierda, volviéndose a obtener un color azul verdoso parecido
al patrón (foto 9)
Por otra
parte la dilución de la reacción, al agregar sucesivas gotas, va a favorecer
la producción de iones cúprico tetrahidratados planos, modificándose la estructura espacial del complejo, ya que el CuCl42-
es tetraédrico. Ello hace que en la foto aparezca un color final azul
verdoso
El nuevo
proceso sería:
CuCl4 2- + 4H2O ![]() Cu(H2O)4 2+ +
4Cl-
Cu(H2O)4 2+ +
4Cl-
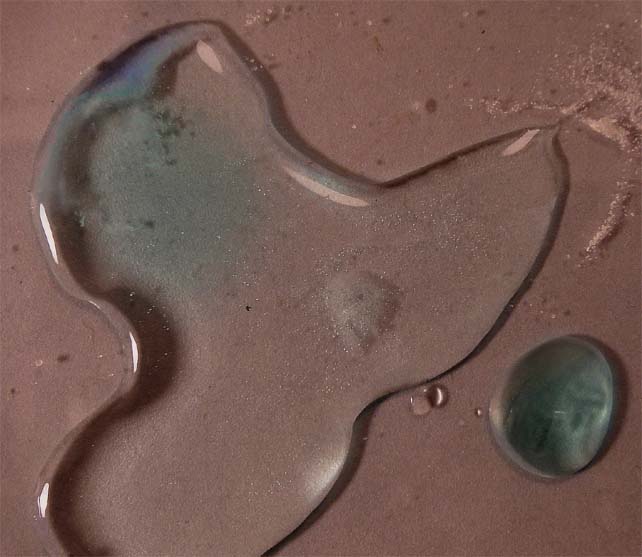
foto 9
El origen
de los cambios de color en el desplazamiento de equilibrio por intercambio
de ligandos, se debe a que éstos provocan energías de desdoblamiento diferentes,
que dan lugar a la absorción de distintas energías.
Se van a explicar los cambios de color en función de las energías de desdoblamiento, que se pueden evaluar para el ión central y los respectivos ligandos, siguiendo los parámetros de Jørgensen, y teniendo en cuenta que el color que se observará será el complementario del absorbido según la energía de desdoblamiento.
Los parámetros de Jørgensen (g y f) aplicados el ion cúprico (g), con los ligandos que intervienen (f) y su intercambio, indicarán una energía de desdoblamiento orbital dada por el producto de ambos parámetros (fg). Así, según lo mencionado y los valores de dichos parámetros incluidos en la tabla, se tendrá:
| Central( Cu2+):g.
(cm-1) |
ligando: parámetro f |
energía desdoblamiento
(cm-1) fg |
color que se
ve |
| 15700 |
H2O
= 1 |
15700 |
AZUL |
| |
Cl-
= 0,78 |
12246 |
VERDE |
| |
NH3
= 1,1 |
17270 |
AZUL OSCURO |
Por eso al intercambiarse los ligandos en
los diferentes equilibrios que se forman, la disolución cambia de color
según que domine la concentración de una forma u otra.
3.
EQUILIBRIO ENTRE EL HIERRO(III) Y EL TIOCIANATO

foto 10
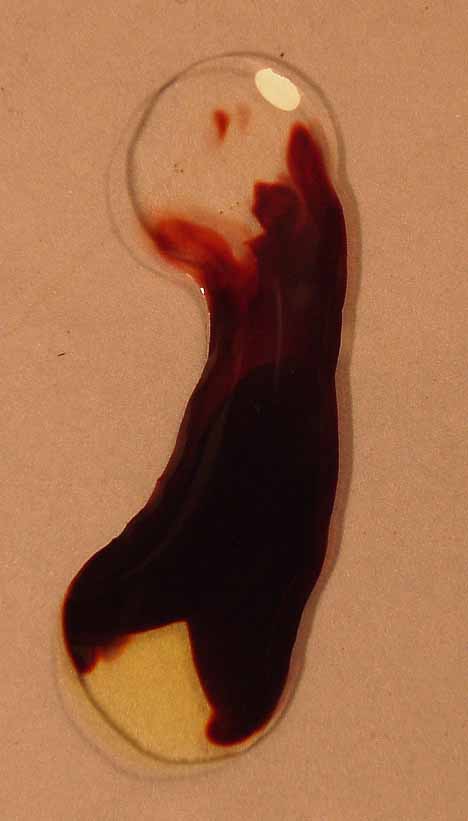
foto 11
Un desplazamiento de equilibrio realmente vistoso,
es el que se puede conseguir a partir de los complejos que forma con el
catión Fe(III), el tiocianato, puesto que el color es un rojo muy fuerte
(por eso a dicha reacción se la denominó “sangre de toro”).
Para elllo se dispondrá una gota de cloruro de hierro (III) (amarillo), y otra de tiocianato amónico (incoloro), tal como muestra la foto 10. Al unirlas se produce la reacción en equilibrio ligeramente desplazado hacia la derecha, que se muestra en la foto 11
Como
lo que interesa son los iones Fe3+ y SCN-, que están en disolución, se puede esquematizar:
Fe 3+ (aq) + SCN- (aq)
Fe(SCN)2+ (aq)
Ahora se tratará de desplazar el equilibrio
en uno u otro sentido. Si lo hace hacia la izquierda resultará incoloro
mientras que a la derecha será rojo fuerte.
Si se agrega ortofosfato sódico cristalizado
(foto 12) este reaccionará con el Fe3+, retirándolo del equilibrio,
a esta acción externa el equilibrio reacciona desplazándose hacia la izquierda,
para producir mas Fe3+ (foto 13), perdiendo el color
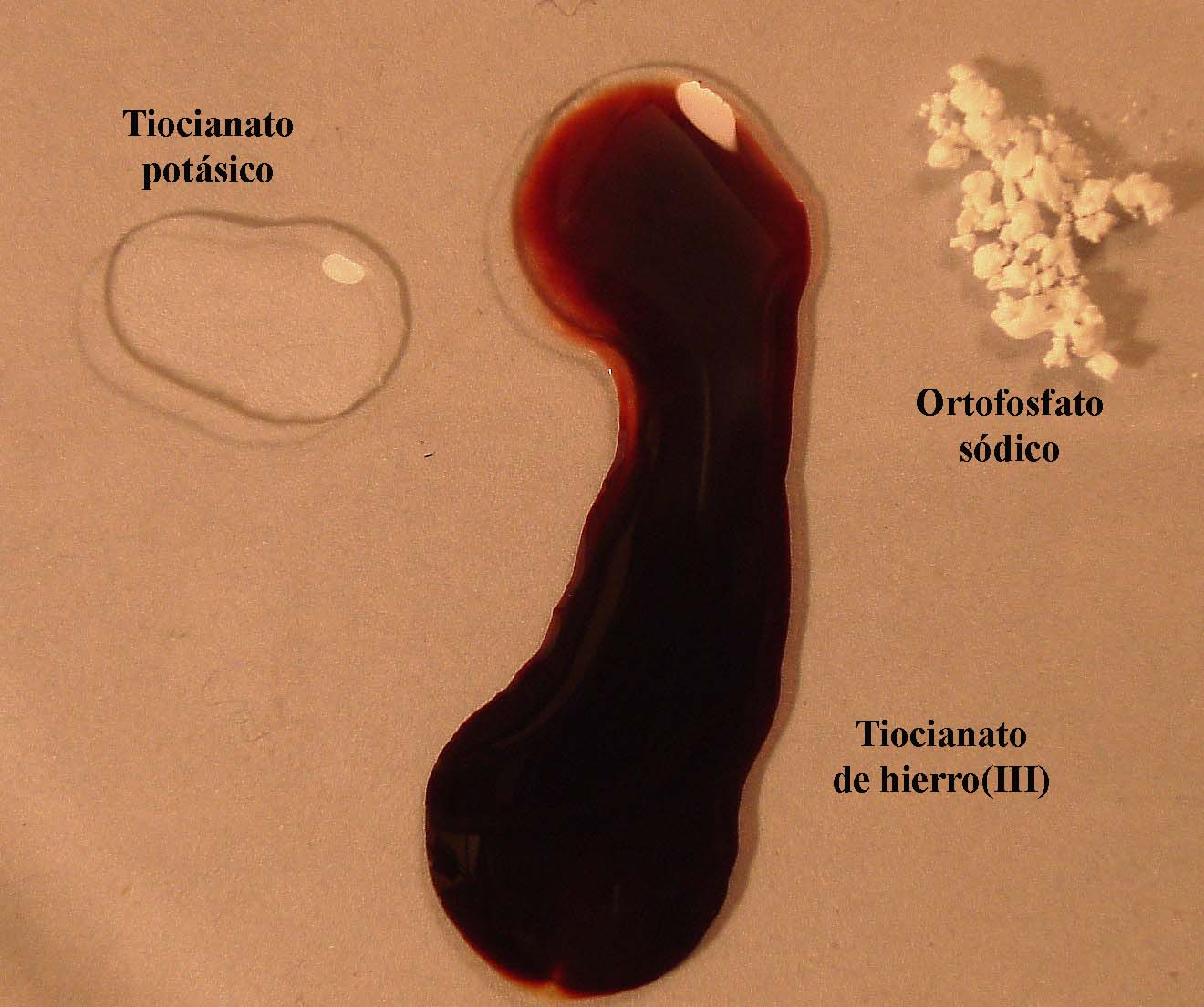
foto 12
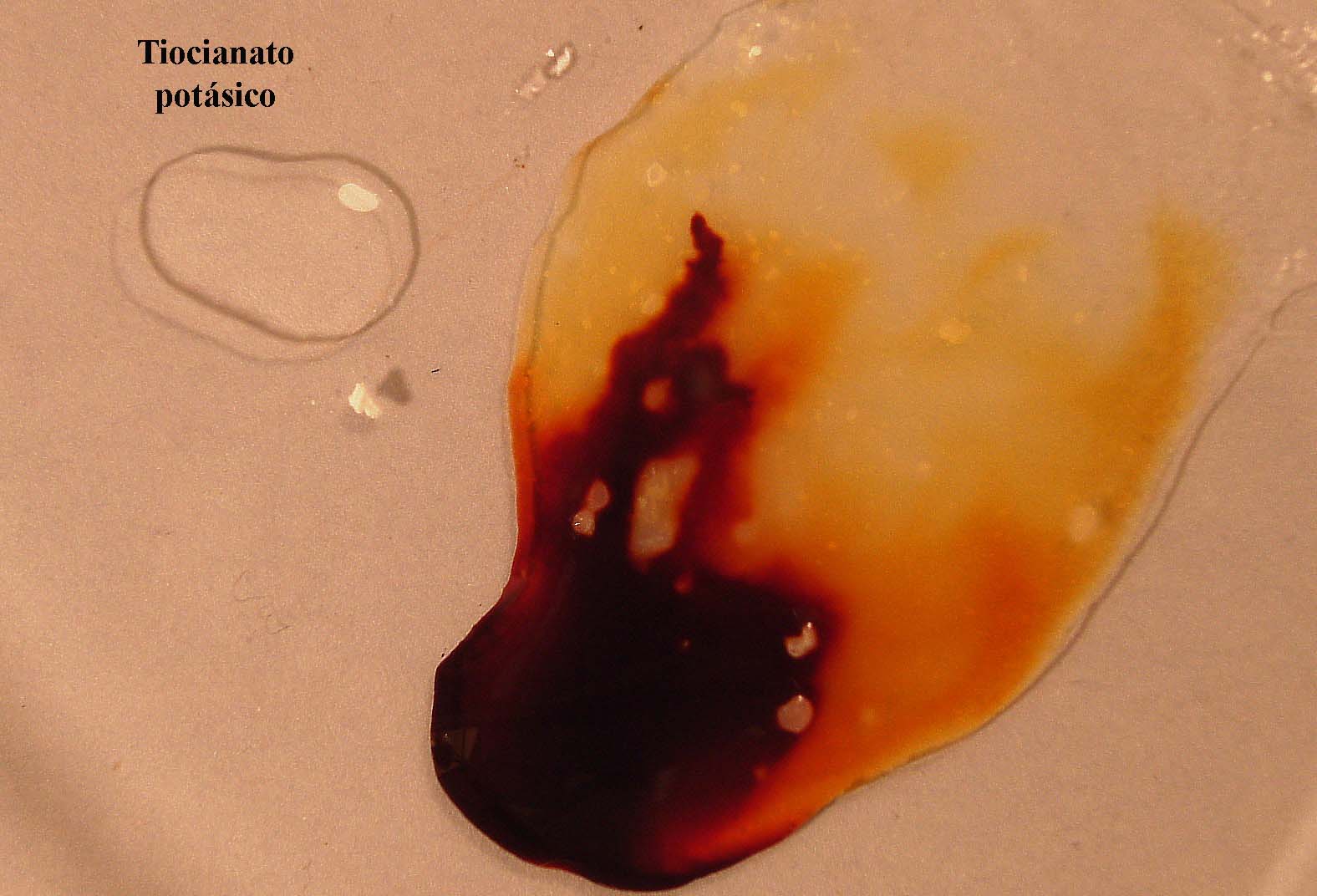
foto 13
Sin embargo si se agrega tiocianato potásico,
K+(aq) SCN- (aq), éste
aporta iones tiocianato, que obligarán al sistema a consumirlos, por lo
que se desplazará hacia la derecha, volviendo el color rojo (foto ( 14).
Si se agrega HgCl2, los iones Hg2+,
se unen al tiocianato, retirándolo de la disolución y obligando al equilibrio
a desplazarse nuevamente hacia la derecha perdiendo el color (fotos 15
y 16).
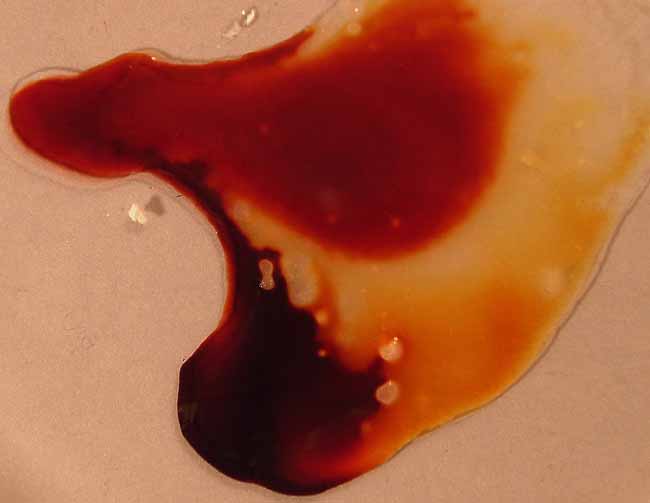
foto 14
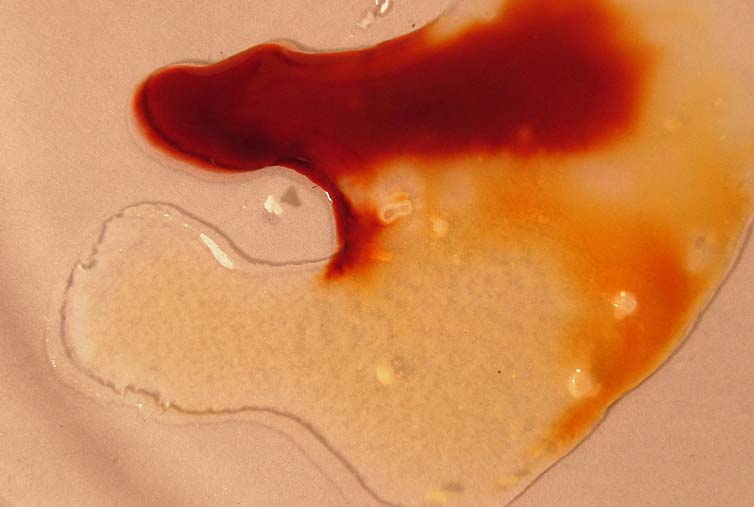
foto 16
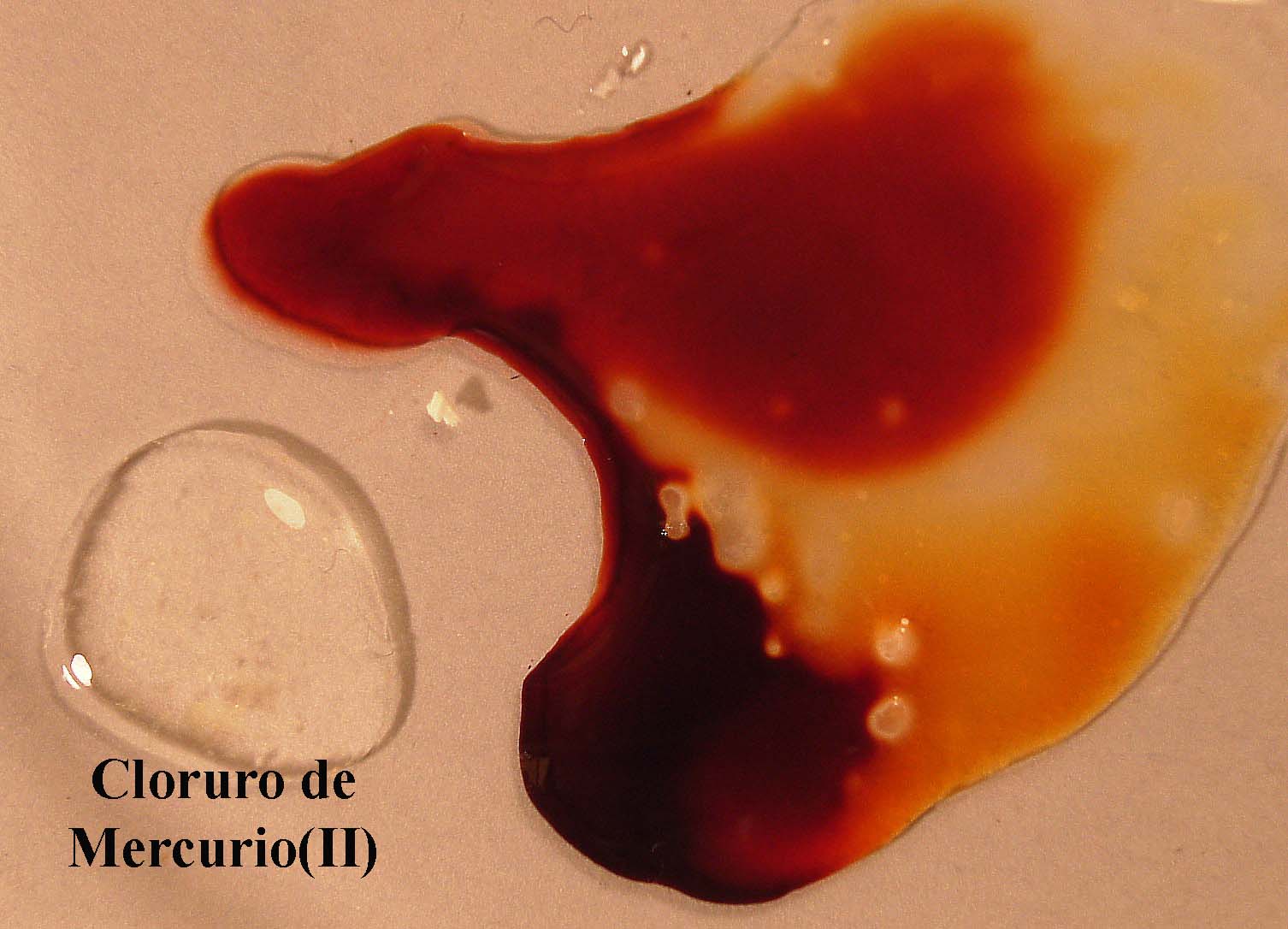
foto 15
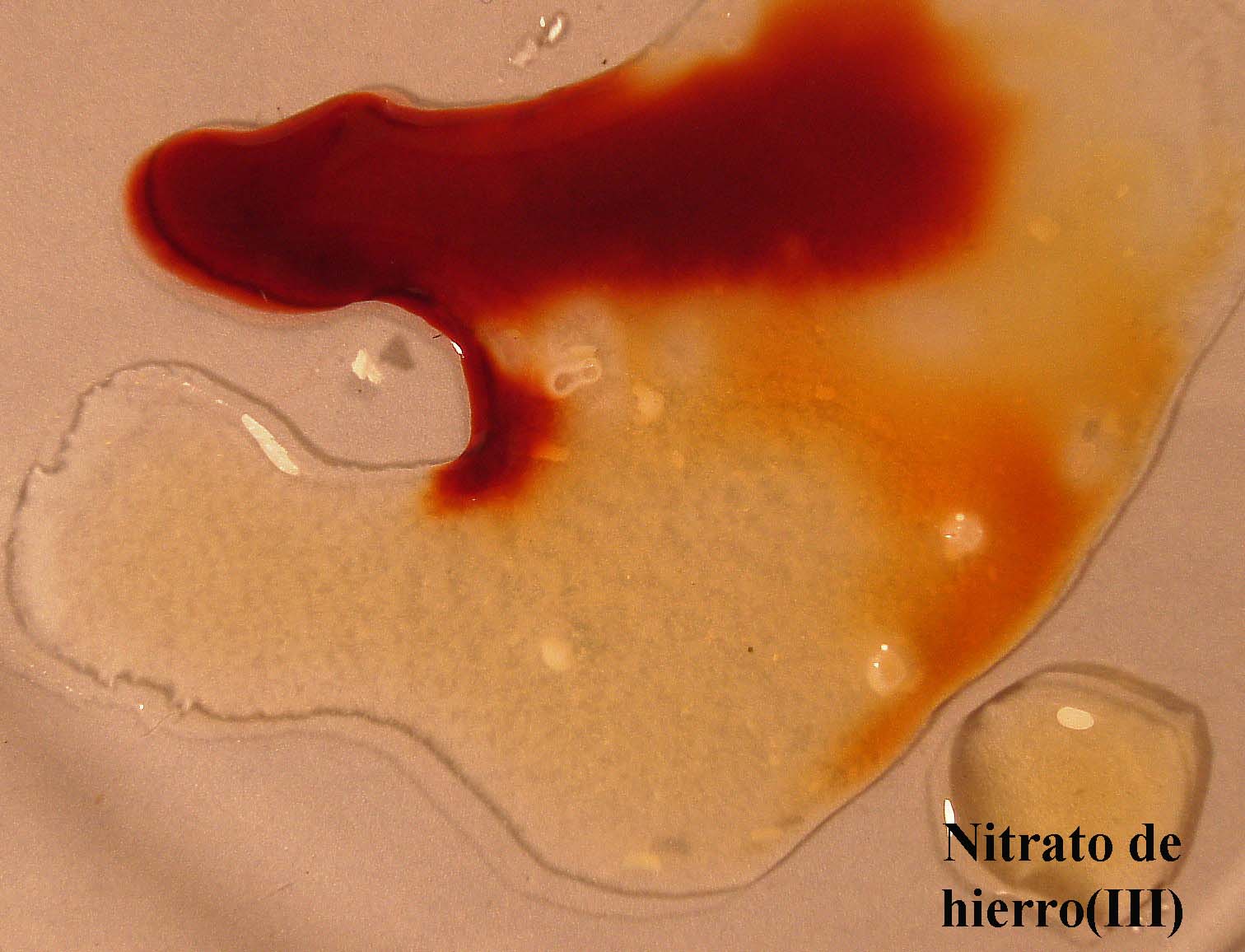
foto 17
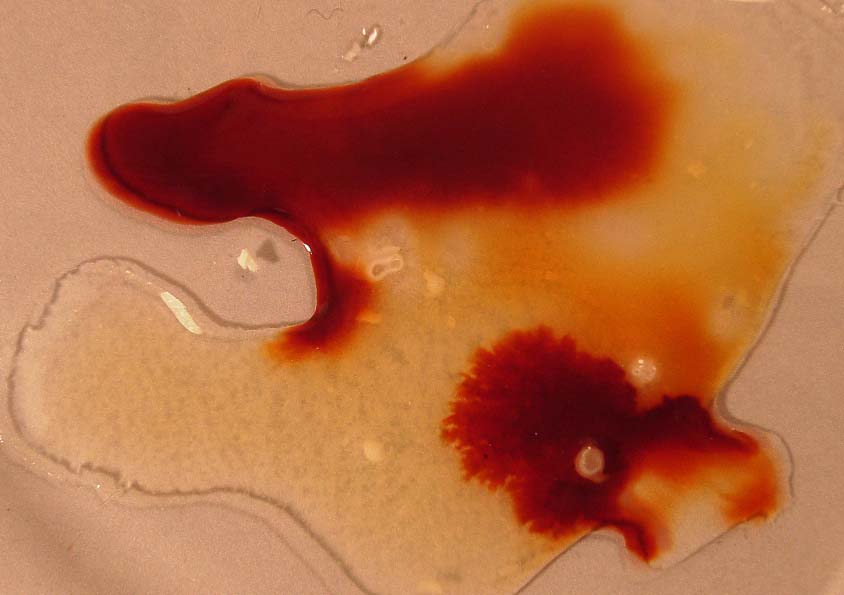
foto 18
[1] En ese mismo sentido, e independientemente, F.Braun, publicó en la revista alemana Z.Physik.Chem en 1887, unas leyes similares.
[2] El texto dice:@Tout système en équilibre soumis à une action capable
de le déformer ne peut éprouver que des modifications qui tendent
à produire une réaction de nature semblable, mais de signe contraire
à l=action qu=il subit, et réciproquement@.