
Fig.1
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
ÁCIDO CLORHÍDRICO
Y PLOMO
1.Ácido clorhídrico
1,1M y granos de plomo
Se opera como en prácticas anteriores, con unos granos de plomo, y una gota de ácido clorhídrico 1,1M (fig.1), en una superficie máxima de 2cm2. En este caso la reacción es muy débil, burbujeando al cabo de media hora, con desprendimiento de hidrógeno apenas perceptible, aunque se amplie la imagen (fig.2 ). La reacción se debilita con el tiempo (fig3 y 4).
El proceso principal
que tiene lugar en las fotografías es el siguiente:
REDUCC:
2HCl + 2e- =
H2(g) + 2Cl 1-
OXIDAC: 2Pb - 6e =
Pb2+
______________________________________________
2HCl +Pb = H2(gas)+
PbCl2
Las fotografías del proceso son las siguientes:

Fig.1
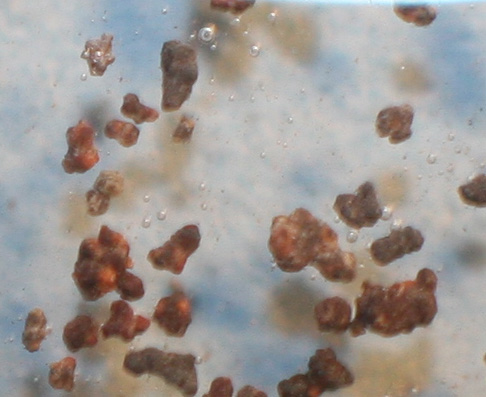
Fig.2 (ampliación)

Fig.3 (detalle)
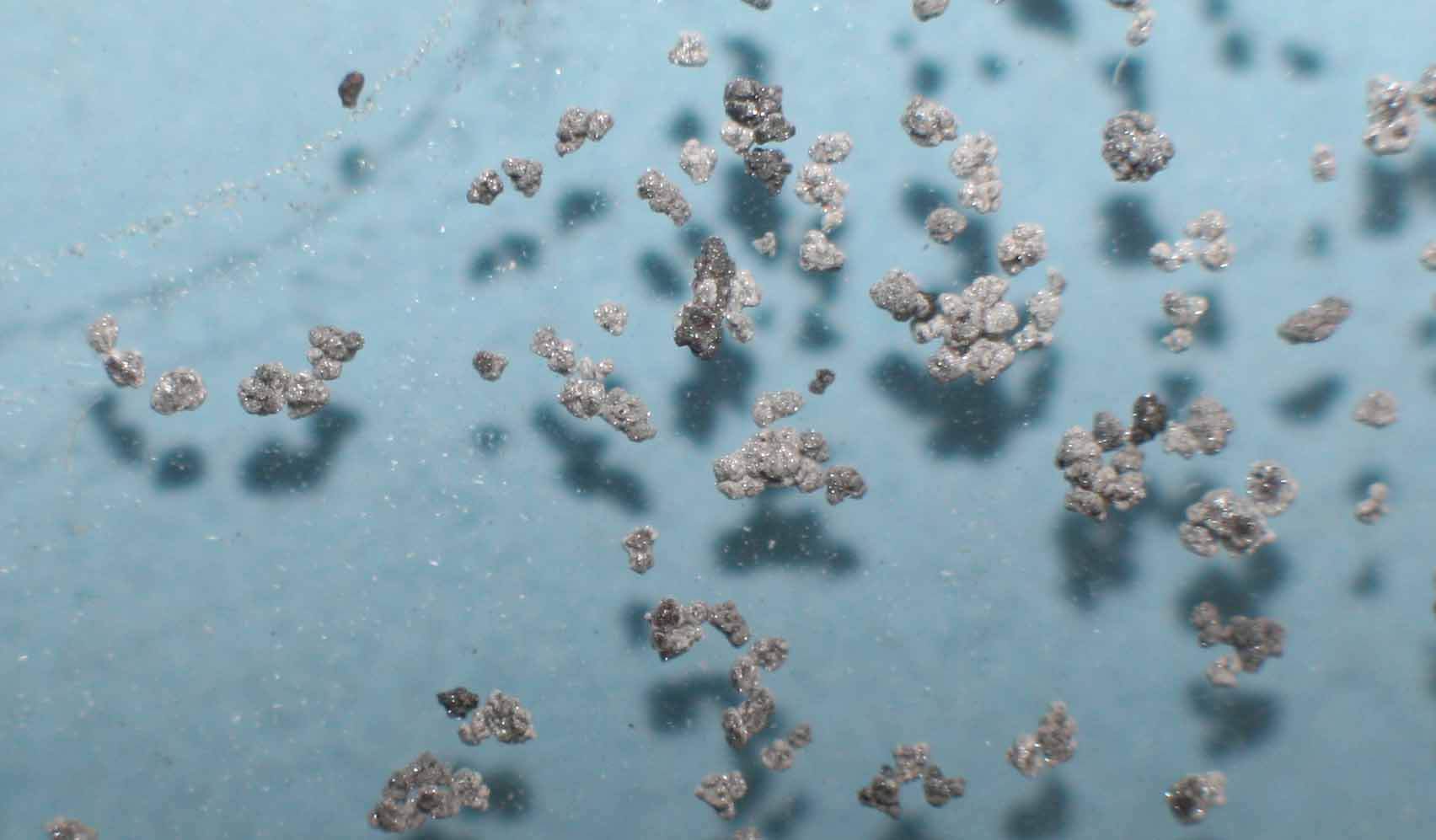
Fig.4
2. Ácido clorhídrico 11M + granos de plomo
Se opera como en el caso anterior
(fig.5). En este caso la reacción es similar a la anterior y no más violenta, como ocurría con otros metales.
El desprendimiento de hidrógeno se produce antes, pero las burbujas son difíciles de visualizar aún ampliando la
imagen(fig.6-8).

Fig.5

Fig.6

Fig.7 (ampliación)

Fig.8
ÁCIDO CLORHÍDRICO
Y ESTAÑO
1.Ácido clorhídrico
11M y lámina de estaño
Dado que con ácido clorhídrico 1,1M, practicamente no reacciona,
sólo se visualizará la reacción con el HCl 11M. En este caso la reacción
es muy débil (fig 9), atacándose la lámina de estaño, con desprendimiento
de hidrógeno apenas perceptible, aunque se amplie la imagen (fig.10 y 11 ).

Fig.9

Fig.10

Fig.11
El proceso principal
que tiene lugar en las fotografías es el siguiente:
REDUCC:
2HCl + 2e- =
H2(g) + 2Cl 1-
OXIDAC: 2Sn - 6e =
Sn2+
______________________________________
2HCl +Pb = H2(gas)
+ SnCl2