
Fig.1
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
ÁCIDO CLORHÍDRICO
Y MAGNESIO
1.Ácido clorhídrico
1,13M y cinta de magnesio
Se opera como en prácticas anteriores, con un fragmento de cinta de 1 cm. de longitud, y una gota de ácido clorhídrico 1,13M (fig.1). en una superficie máxima de 2cm2 . En este caso la reacción es muy fuerte, burbujeando desde el primer momento, desprendiendo hidrógeno (fig.2). Las burbujas son tan fuertes que desenfocan la foto y el gas produce una corriente al salir, como si fuera una fuente de hidrógeno (fig. 3). La reacción es tan fuerte que parte la cinta de magnesio (fig.4-6).La reacción se debilita al cabo de media hora, formándose un precipitado amorfo de cloruro de magnesio ( fig.7).
El proceso principal
que tiene lugar en las fotografías es el siguiente:
REDUCC:
2HCl + 2e- =
H2(g) + 2Cl 1-
OXIDAC: Mg - 2e =
Mg2+
______________________________________________
2HCl +Mg= H2(gas)+
MgCl2
Las fotografías del proceso son las siguientes:

Fig.1

Fig.2(detalle)

Fig.3

Fig.4
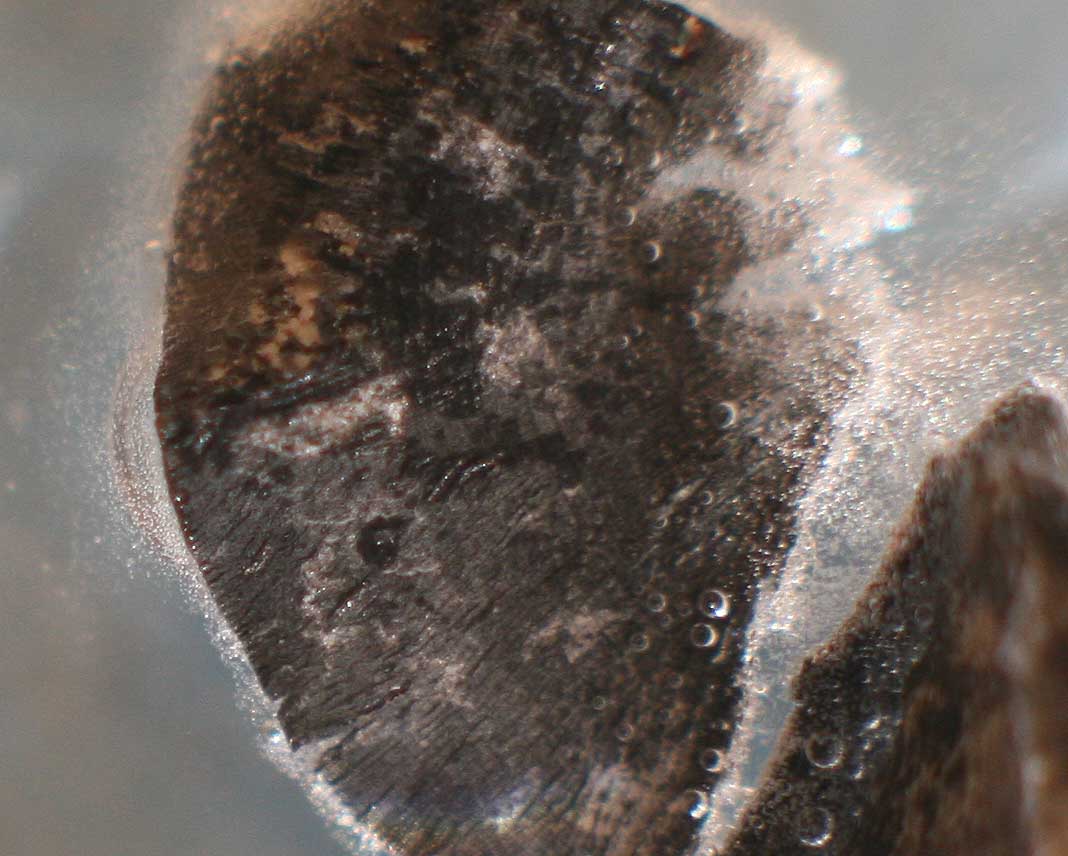
Fig.5

Fig.6(detalle)

Fig.7
2. Ácido clorhídrico 11,3M + cinta de magnesio
Se opera como en el caso anterior (fig.8). En este caso la reacción es similar a la anterior pero mucho más violenta, hasta el punto de que los gases desprendidos desenfocan completamente la imagen. (fig.9). El desprendimiento de hidrógeno produce múltiples burbujas (fig. 9). Al cabo de 15 minutos la reacción toma es aspecto indicado en la fig. 10. Rápidamente se termina la reacción, cristalizando el MgCl2 (fig.11)

Fig.8
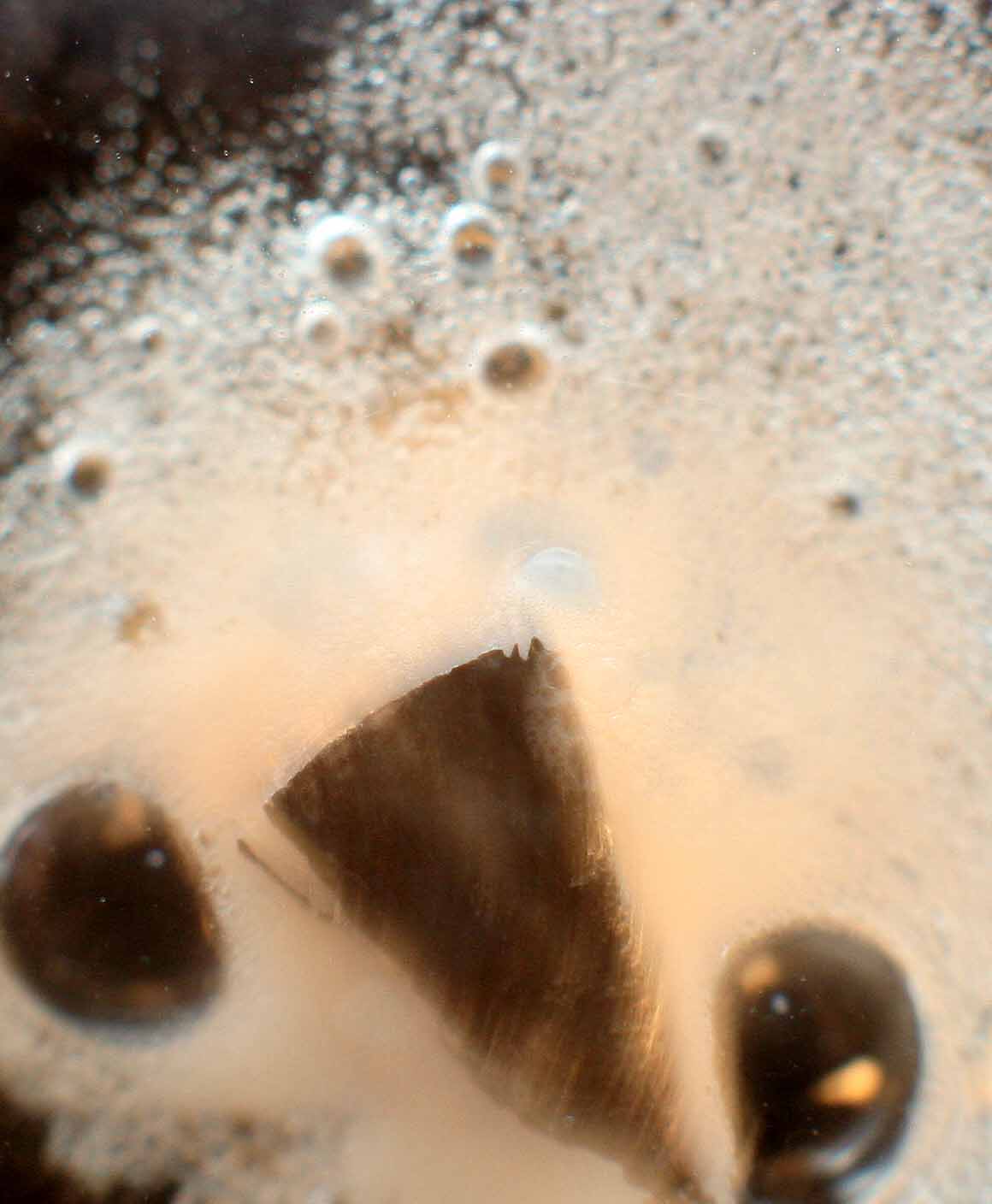
Fig.9

Fig.10

Fig.11