
Fig.1
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
Ácido sulfúrico y
moneda de aluminio
1. Con ácido sulfúrico
9M
Se opera como en prácticas anteriores, con moneda de aluminio, y una gota de ácido sulfúrico concentrado (fig.1). Si se recuerda, este ácido reaccionaba de forma diferente con monedas de cobre, y con monedas de níquel. En este caso la reacción es inmediata, burbujeando los gases desprendidos al instante (fig.2 y 3). Después se desarrolla violentamente, cesando al cabo de media hora. A partir de un determinado momento comienza a formarse un precipitado gelatinoso de sulfato de aluminio (fig.4 y 5), aunque siguen desprendiéndose burbujas de hidrógeno (fig.6, 7 y 8). Obsérvese que las burbujas de estas últimas fotos son diferentes.
El proceso principal
que tiene lugar en las fotografías es el siguiente:
REDUCC: 3H2SO4
+ 6e- = 3SO4
2-+ 3H2
OXIDAC:
2Al - 6e =
2Al3+
______________________________________________
3H2SO4
+2Al = H2(gas)+
Al2(SO4)3
Proceso secundario:
REDUCC:
6H2SO4 +
6e- = 3SO2 (g)+ 6H2O
+ 3SO4 2-
OXIDAC: 2Al - 6e =
2Al3+
______________________________________________
3H2SO4
+2Al = 3SO2(gas)+
Al2(SO4)3 + 6H2O

Fig.1

Fig.2 (ampliación)

Fig.3
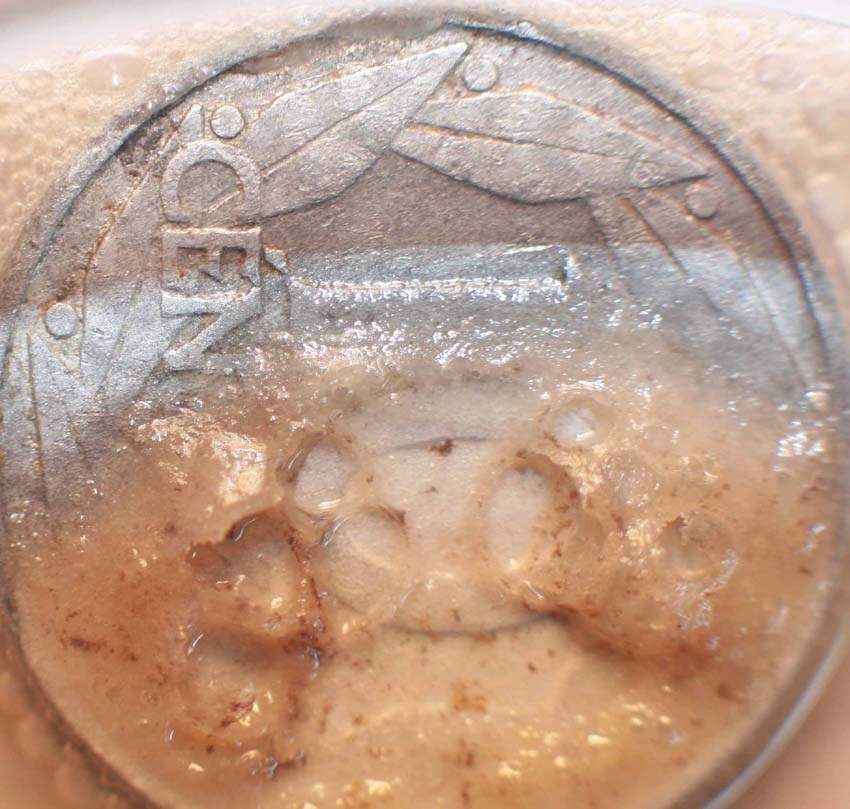
Fig.4

Fig.5

Fig.6(detalle)

Fig.7 (detalle)
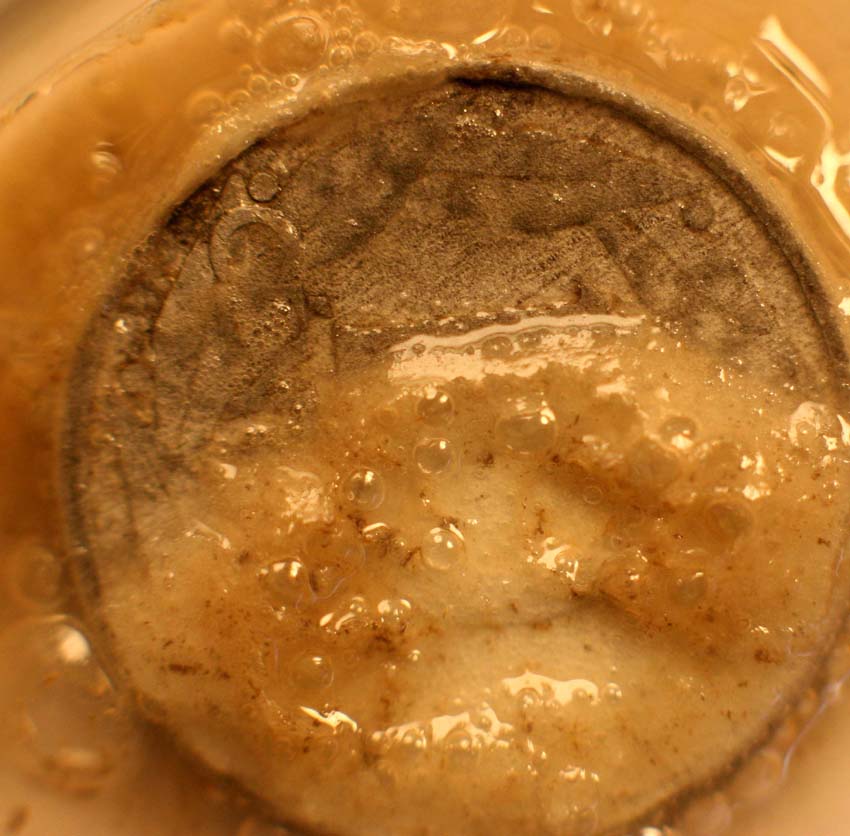
Fig.8
2.Con ácido sulfúrico
1M
La reacción es mucho más lenta, como es lógico, y tenues burbujas comienzan después que el sulfúrico se calienta ligeramente (fig. 9 y 10). La aparición de burbujas aumenta sin ser violentas (fig.11,12 y 14). Al cabo de una hora comienza a aparecer el precipitado gelatinoso, desapareciendo las burbujas (fig. 13 y 15).
Las reacciones son las mismas que se describieron en el apartado anterior.

Fig.9

Fig.10(detalle)

Fig.11

Fig.12(detalle)

Fig.13 (detalle)

Fig.14

Fig.15