
Fig.1
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
Ácido sulfúrico y
monedas de cobre
Con ácido sulfúrico
9M
Vamos a repetir la práctica anterior, pero empleando esta vez una moneda de cobre y una gota de ácido sulfúrico concentrado (fig.1). Si se recuerda, con el ácido nítrico, la reacción era inmediata. Aquí tarda casi media hora en comenzar la reacción, y el sulfúrico o el cobre deben estar calientes, sino apenas reacciona. Sin embargo la reacción es mucho mas complicada (no se aprecian burbujas), y se observa la aparición de un precipitado marrón gelatinoso, seguido de pequeñas deposiciones oscuras (negras), todo ello es debido a la formación previa de sulfato de cobre (I), y sulfuro cuproso (negro) al cabo de un tiempo irán apareciendo los clásicos cristales de sulfato de cobre (II), verde azulados. La sucesión de hechos se explica con las reacciones repetidas de la práctica anterior, y la secuencia fotográfica es la dada.(fig1-6).
Proceso general
REDUCC: 2H2SO4 + 2e- = SO4 2-+ SO2+ 2H2O
OXIDAC: Cu - 2e =
Cu2+
_____________________________________________
H2SO4
+Cu = SO2(gas)+
CuSO4
Procesos secundario previos
REDUCC:
4H2SO4 +
8e- = S2-+ 4H2O + 3SO4 2-
OXIDAC: 8Cu - 8e- =
8Cu1+
______________________________________________
4H2SO4
+8Cu = Cu2S+ 3Cu2SO4+
4H2O
REDUCC:
4H2SO4 +
8e- = S2-+ 4H2O + 3SO4 2-
OXIDAC:
4Cu2SO4 - 8e- =
8Cu2+ +4SO4
_____________________________________________
4H2SO4
+4Cu2SO4
=
S2-+ 7CuSO4+ 4H2O+Cu2+
Cu2SO4
= 2Cu1+ +SO42-
_____________________________________________
4H2SO4
+5Cu2SO4 = Cu2S+
8CuSO4+ 4H2O
Estos dos procesos secundarios dan lugar a la conocida ecuación de Pickering:
4H2SO4 +5Cu =
Cu2S+ 3CuSO4+ 4H2O
que justifican el que no se aprecien burbujas de gas, y sí en cambio, motas
negras de sulfuro cuproso, y cristales de sulfato de cobre(II)

Fig.1

Fig.2

Fig.3 (detalle)

Fig.4 (detalle)

Fig.5 (ampliación)

Fig.6
2. Ácido sulfúrico 9M sobre moneda con apariencia de cobre.
Vemos que la reacción es completamente distinta, con una producción violenta de gas (hidrógeno), y la final aparición de un precipitado gelatinoso. Esto ocurre porque estas monedas están “aligeradas”, con aluminio, hierro y níquel, responsables de la producción de hidrógeno, tal como se ha visto en anteriores, “químicas a la gota” (QG48 y QG49).

Fig.7
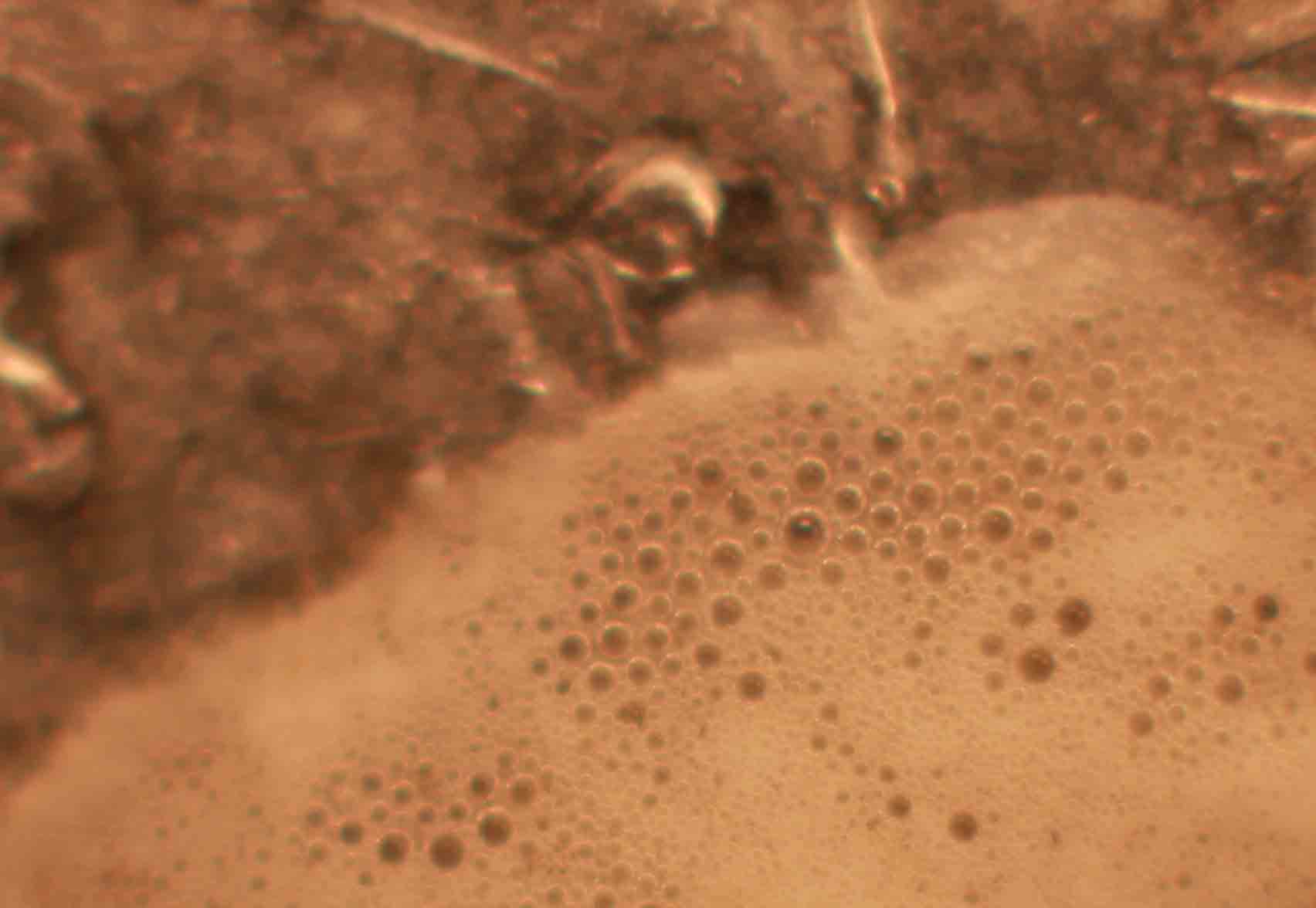
Fig.8(detalle)
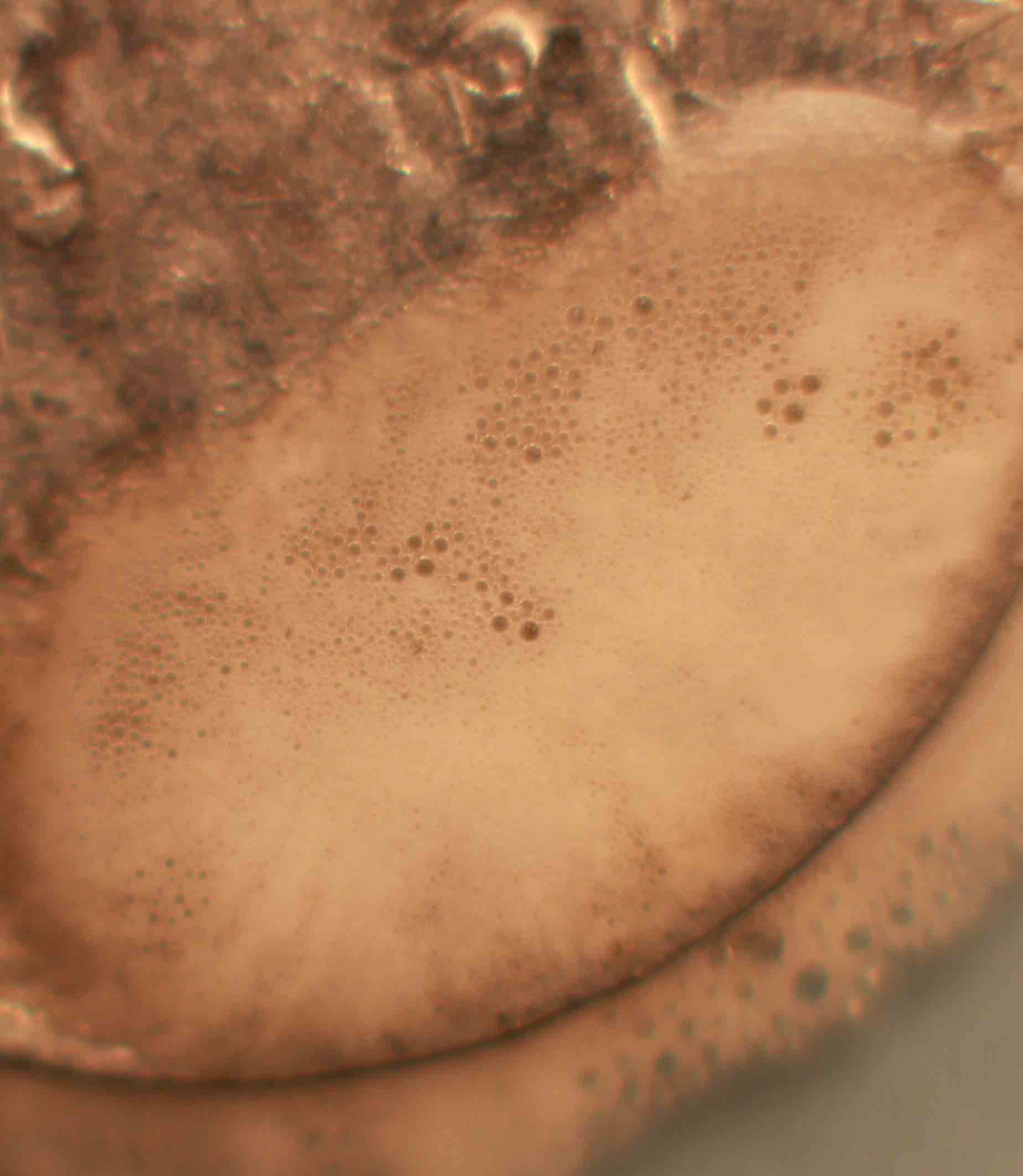
Fig.9

Fig.10
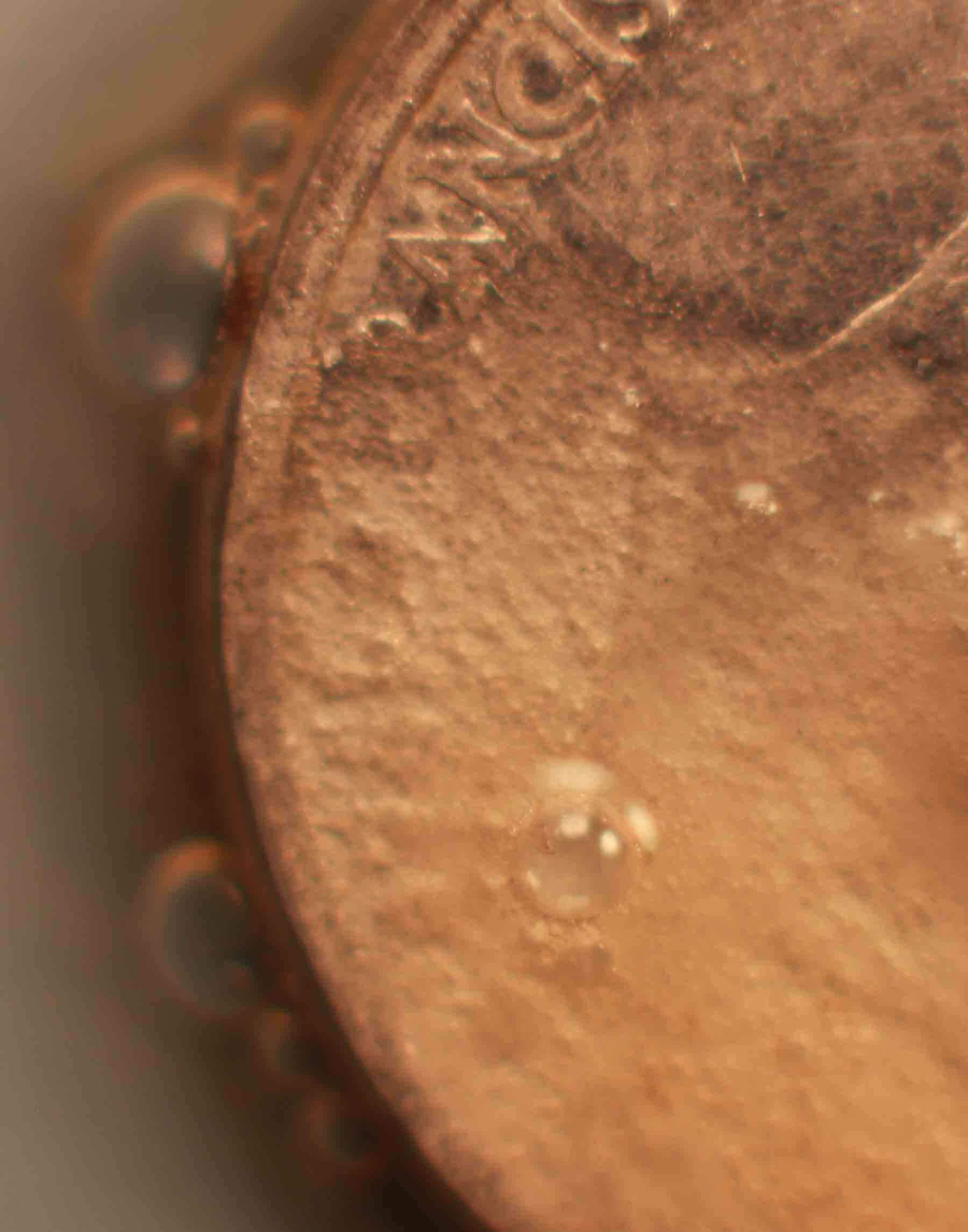
Fig.11

Fig.12
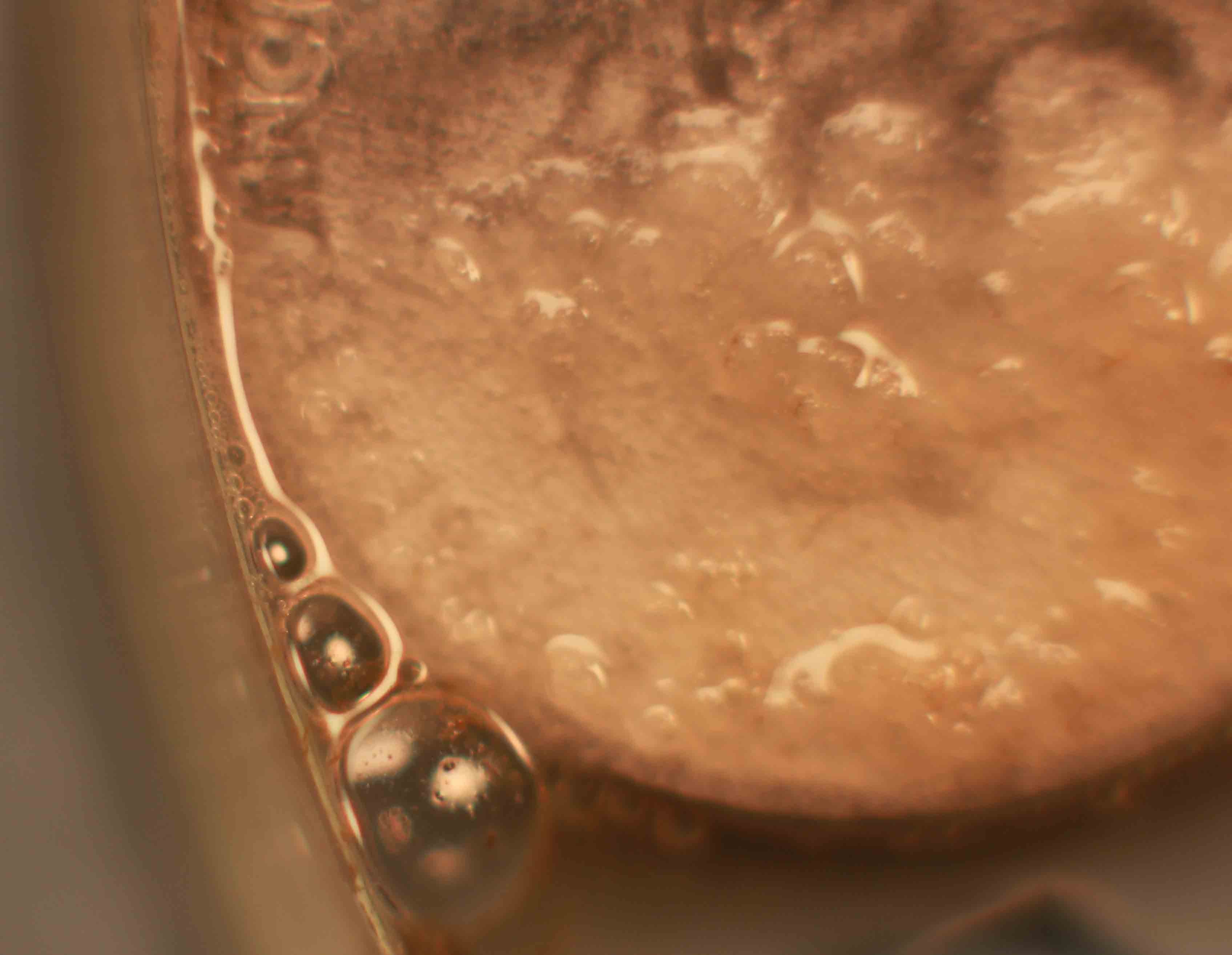
Fig.13 (detalle)

Fig.14