
Fig.1
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
Ácido sulfúrico y
magnesio
1. Con ácido sulfúrico 9M
Se opera como en prácticas anteriores, con una cinta de
magnesio de algo menos de 1 cm2, y una gota de ácido sulfúrico
concentrado (fig.1). La reacción es
inmediata, burbujeando rápidamente hidrógeno (fig.2). En determinado momento
forma una gran burbuja, como puede apreciarse en la fig.4-9, a través de la
cual se puede apreciar al autor haciendo la fotografía (fig.6). Al final del
proceso se aprecia la formación del precipitado blanco de sulfato de magnesio
La reacción principal que visualizan las fotografías es:
REDUCC: H2SO4
+ 2e- = SO4 2-+
H2
OXIDAC:
Mg + 2e =
Mg2+
______________________________________________
H2SO4
+Mg = H2(gas)+ MgSO4

Fig.1

Fig.2


Fig.3 (ampliación)

Fig.4

Fig.5

Fig.6 (ampliación)

Fig.7

Fig.8 (ampliación)

Fig.9

Fig.10
2. Con ácido sulfúrico
1,5M
Se produce la misma reacción (fig 11-15). Sin embargo las burbujas son mucho mas pequeñas. No se aprecia el precipitado de sulfato de magnesio

Fig.11
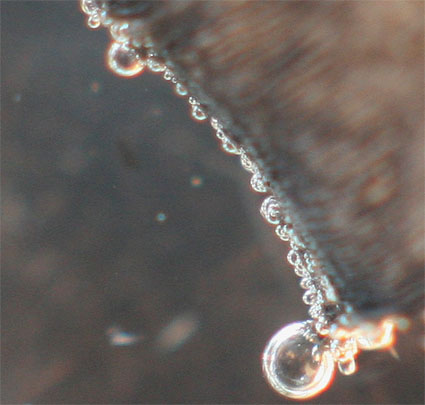
Fig.12(ampliación)

Fig.13

Fig.14

Fig.15(ampliación)











