
Fig.1
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
Reacción a la gota
entre el ácido sulfúrico y cinc
1. Con ácido sulfúrico 9M
Se opera como en prácticas anteriores, con una chapa metálica de cinc de algo menos de 1 cm2, y una gota de ácido sulfúrico concentrado (fig.1 y 2). La reacción no es inmediata (fig.3), burbujeando violentamente al cabo de algunos minutos (fig.4). El gas desprendido es hidrógeno, a diferencia del gas desprendido cuando se trataba con ácido nítrico concentrado (ver QG43, en esta web). Las burbujas de hidrógeno incoloras, son pequeñas y numerosas, aunque al unificarse más tarde formen burbujas grandes (fig.5), que finalizarán el proceso.
La reacción química principal que se puede observar en las fotografías,
es la siguiente:
REDUCCIÓN: H2SO4
+ 2e- = SO4 2-+
H2
OXIDACIÓN: Zn - 2e =
Zn2+
__________________________________________________________________________
H2SO4
+Zn = H2(gas)+ ZnSO4

Fig.1

Fig.2

Fig.3

Fig.4

Fig. 5(ampliación)

Fig.6
2. Con ácido sulfúrico
1,5M
La reacción química es la misma, con la formación de menos
burbujas, y la aparición final de la
masa blanca gelatinosa de sulfato de cinc.(figs 7-12)

Fig.7

Fig.8

Fig.9

Fig.10 (ampliación)
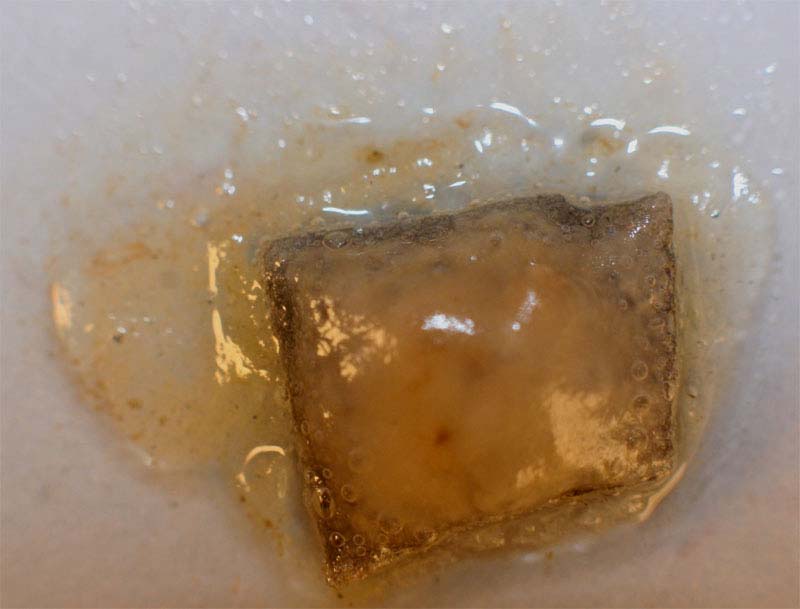
Fig.11

Fig.12