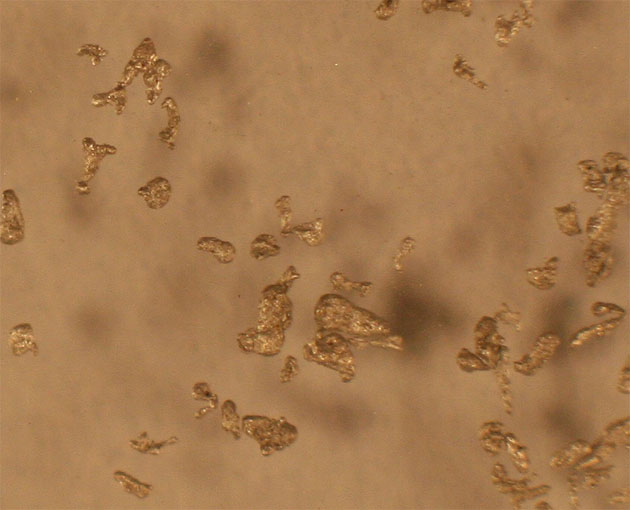
Fig.1
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
REACCIÓN ENTRE EL ÁCIDO NÍTRICO Y EL ALUMINIO EN GRANALLAS
1-Nítrico 13M+ Al
Se opera como en ocasiones anteriores, observándose
que si el ácido nítrico es 13M, la reacción ocurre con desprendimiento escaso
de óxido de nitrógeno(II), al cabo de 20 minutos. Prácticamente hasta la fig
4, no se observa la formación de burbujas. Ya en la fig.5, se aprecian gran
cantidad.

Fig.1
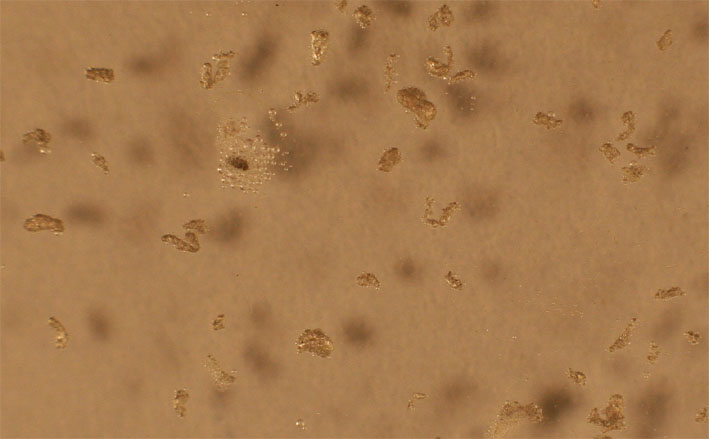
Fig.2
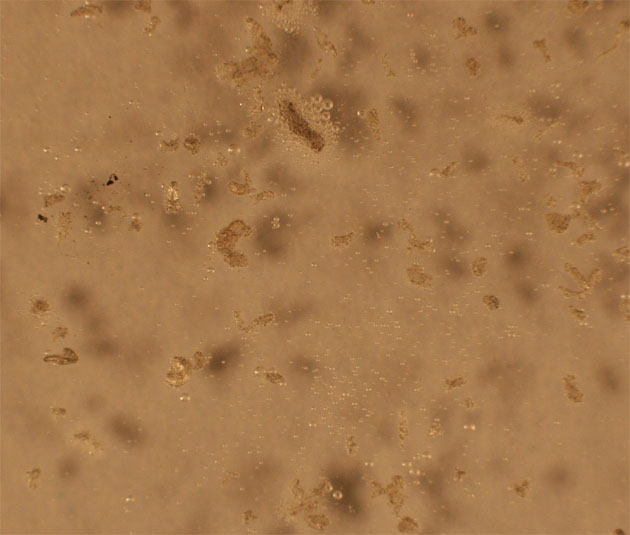
Fig.3
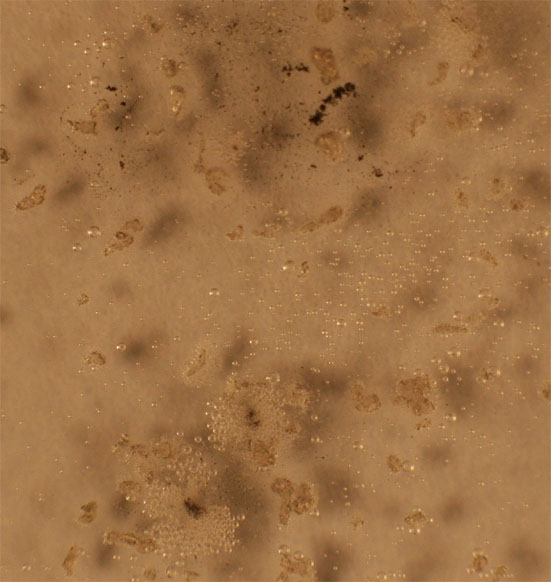
Fig.4

Fig.5 (ampliación)

Fig.6
El proceso redox sería
REDUCC: 8HNO3
+ 6e- = 2NO + 4H2O + 6NO3 -
OXIDAC: 2Al - 6e- = 2Al3+
__________________________________________________
8HNO3 +2Al = 2Al(NO3)3 +
2NO (gas) + 4H2O
2.Nítrico 6,5M+ Al
La reacción casi
no se produce(fig 7-8). Al agregarse una
gota de HCl se desprenden burbujas
en hidrógeno, al reaccionar con este ácido (fig
9-10).

Fig.7
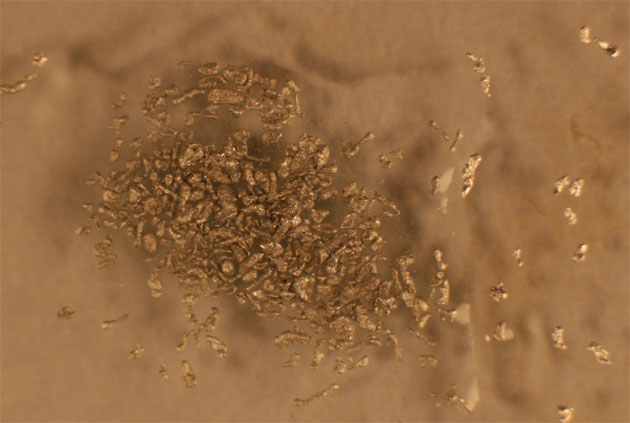
Fig.8
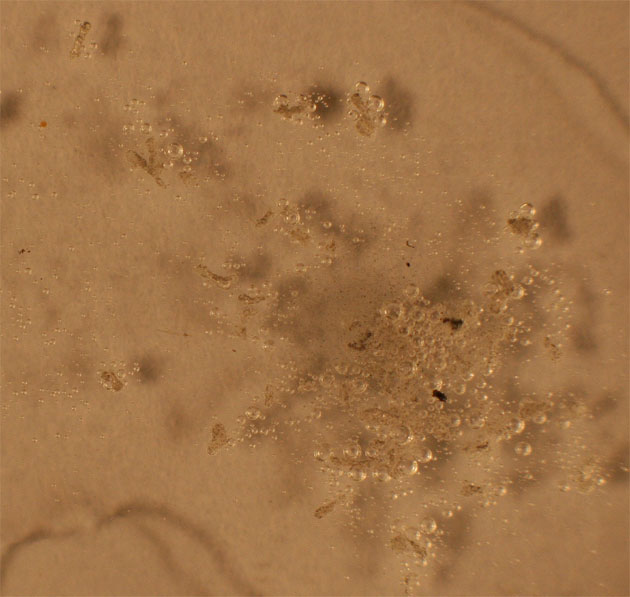
Fig.9

Fig.10(ampliación)
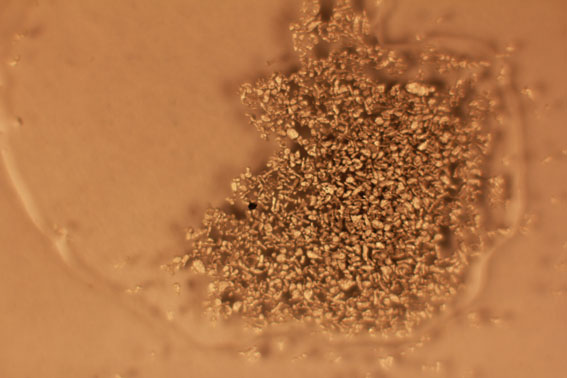
Fig.11
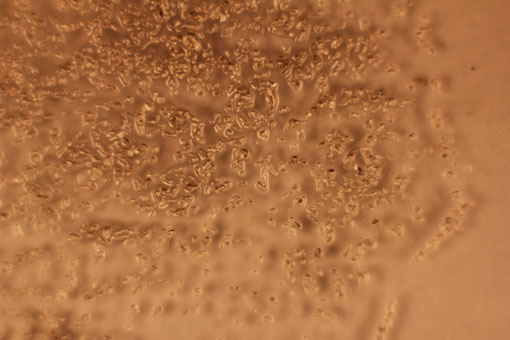
Fig.12