
Fig.1
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
Reacción del ácido
nítrico sobre chapa de cinc
1. Nítrico 13M sobre
cinc.
Se opera como en prácticas anteriores, con una chapa metálica
de cinc de 1 cm2, y una gota de ácido nítrico concentrado. La reacción
es inmediata, burbujeando inmediatamente de forma violenta, los gases desprendidos.
En este caso el dióxido de nitrógeno, marrón que forma una gran burbuja, como
puede apreciarse en la fig.2. Junto con este gas, aparecen pequeñas burbujitas
de monóxido de nitrógeno

Fig.1
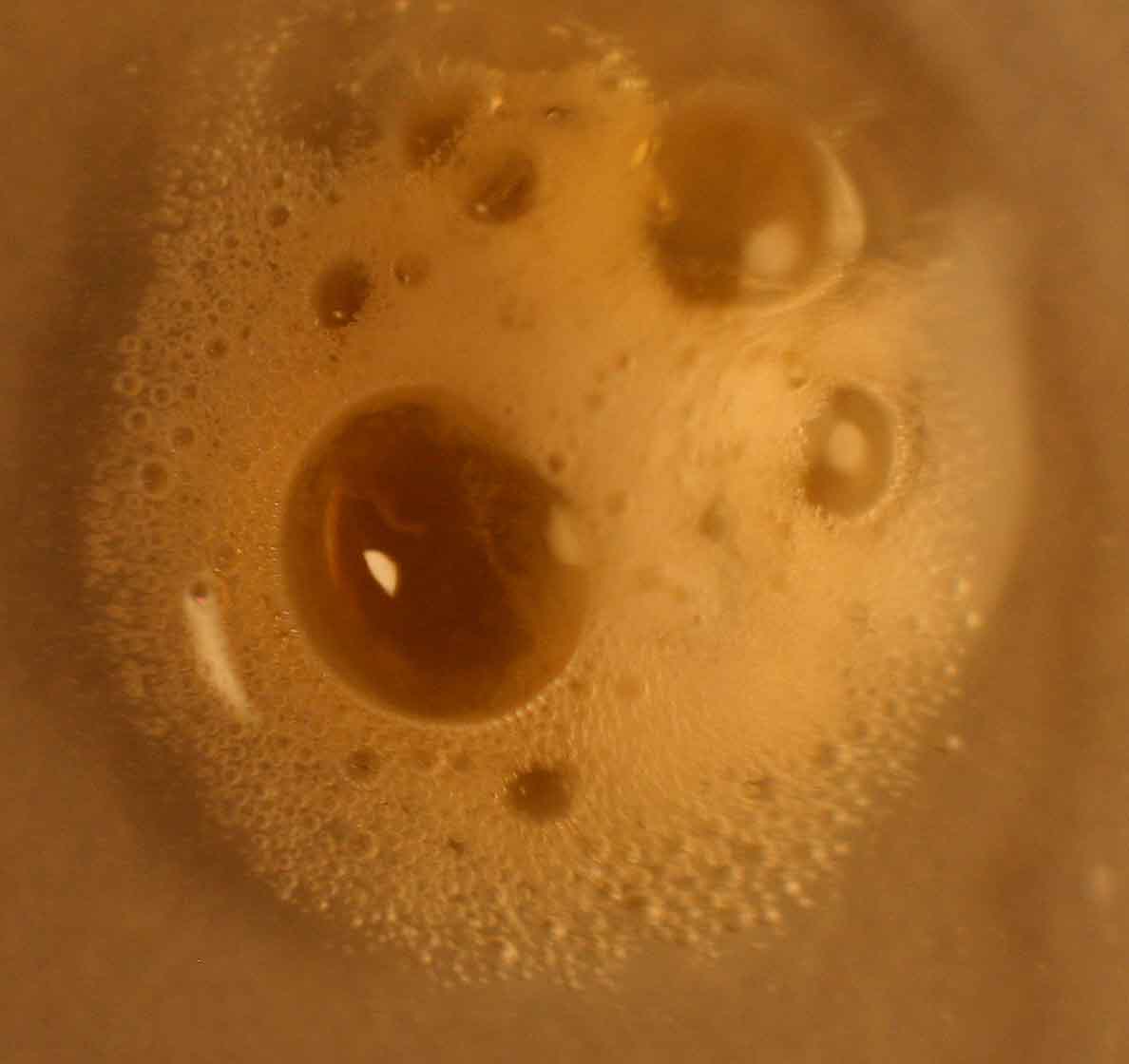
Fig.2
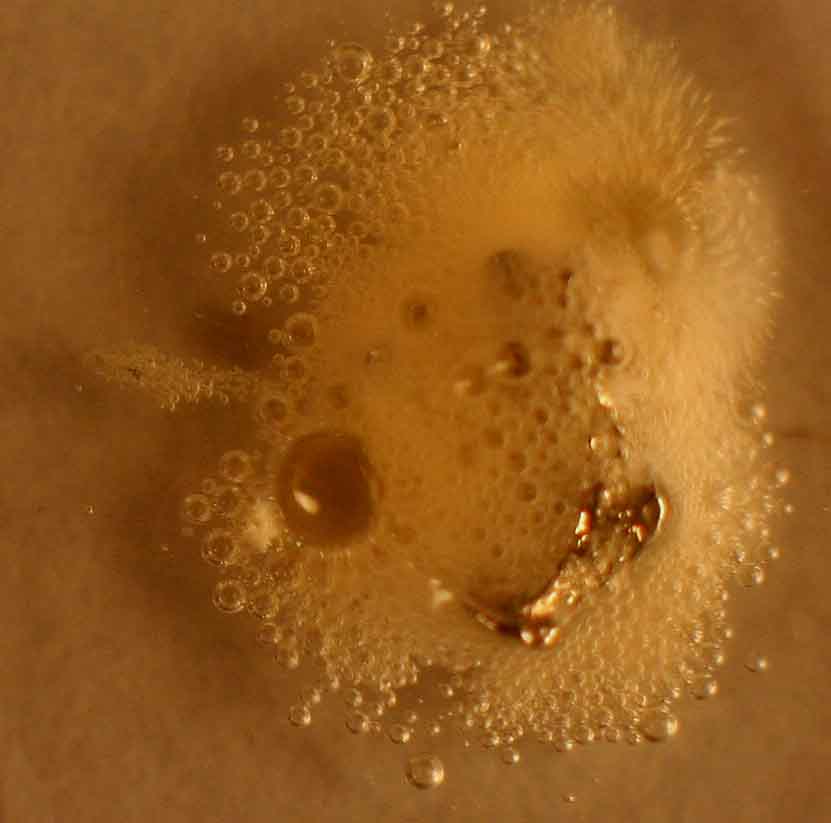
Fig.3
Fig.4
La reacción va
perdiendo la impulsión primera, pero aún se mantiene. La fotografía de la
figura 5, se obtuvo a los 15 minutos de iniciada la reacción.
Fig.5
Los procesos
principales que tiene lugar en las fotografías son los siguientes
REDUCC: 12H+ + 6HNO3 + 12e- = 3NO2 +3NO+ 9H2O
OXIDAC:
6Zn + - 12e =
6Zn2++
__________________________________________________________________________
12H+ + 6HNO3 +12Zn +
=3NO2 (gas marrón) +3NO (gas incoloro) + 9H2O
18HNO3 +6Zn =3NO2 +3NO+ 9H2O+6Zn2++12NO3-
18HNO3 +6Zn
= 6Zn(NO3)2
+ 3NO2 (g) +3NO(g) +9H2O
2. Nítrico 1,5M sobre
cinc
Sin embargo si
el ácido nítrico está mas diluido, el proceso redox es diferente, dado que
se forma óxido de nitrógeno (I), gas, también incoloro. Las reacciones químicas
esperadas son:
REDUCC: 8H+ + 2HNO3 + 8e- = N2O+ 5H2O
OXIDAC: 4Zn + - 8e =
4Zn2++
______________________________________________
8H+ + 2HNO3 +4Zn +
=N2O(gas incoloro) + 5H2O+4Zn2+
10HNO3 +4Zn =N2O+ 5H2O+4Zn2++8NO3-
10HNO3 +4Zn
= 4Zn(NO3)2
+N2O(g) +5H2O
En la toma de fotos se opera como de costumbre. La reacción es mucho más lenta, y las burbujas al principio casi no se aprecian, ya que se forman sobre el propio metal (fig. 7). Después de 30 minutos comienzan a aparecer (fig.8, ampliación). El proceso visualizado (fig.6-11), duró 60 minutos.

Fig.6

Fig.7

Fig.8 (ampliación)

Fig 9 (ampliación)

Fig.10

Fig.11