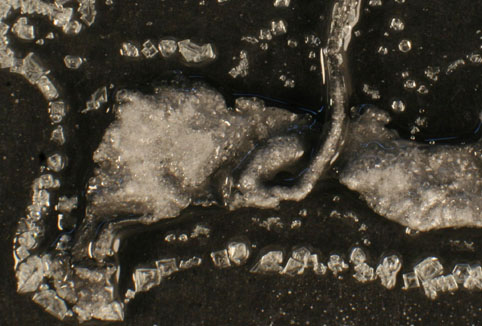
Fig.14
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
REACCIÓN DEL
ÁCIDO NÍTRICO CON PLOMO
1.1. Reacción del HNO3 13M con
plomo.
Comenzaremos en nuestra parte experimental operando como de costumbre, con una gota de ácido nítrico 13M, y pequeña chapa de plomo de 1 cm2 de superficie. (fig.1)
La reacción que se produce:
REDUCC: 4HNO3 + 2e- = 2NO2 + 2H2O + 2NO3 -
OXIDAC: Pb - 2e = Pb2+
__________________________________________________
4HNO3 +Pb =
Pb(NO3)2 + 2NO2 (gas) + 2H2O
Sin embargo a diferencia de la reacción con otros metales, ya explicadas, la dominante es en este caso la producción de óxido de nitrógeno (II) gas incoloro, según reacción:
REDUCC: 8HNO3 + 6e- = 2NO + 4H2O + 6NO3 -
OXIDAC: 3Pb - 6e = 3Pb2+
__________________________________________________
8HNO3 +3Pb =
3Pb(NO3)2 + 2NO (gas) + 4H2O
La secuencia fotográfica presentada Fig. 1-5, se realiza en 20 minutos las primeras, dejando transcurrir dos horas, para obtener la fig.6

Fig.14

Fig.2

Fig.13

Fig.4 (ampliación)

Fig.12(ampliación)
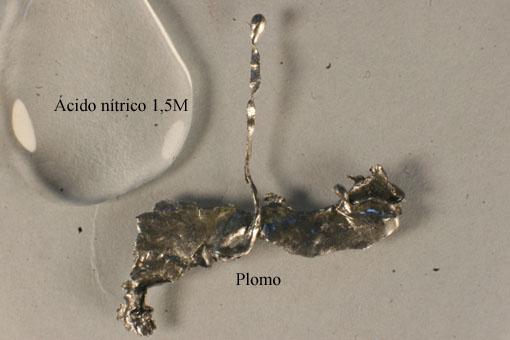
Fig.10
1.2. Reacción del HNO3 1,5M con
plomo (fig.10).
En este caso,
y a diferencia del caso anterior, se aprecia perfectamente el pasivado del
plomo (fig.11), la producción de NO (gas) (fig.12), y la aparición del precipitado gelatinoso del nitrato
de plomo (II) y su posterior cristalización en cristales octaédricos (fig.
13 y 14).
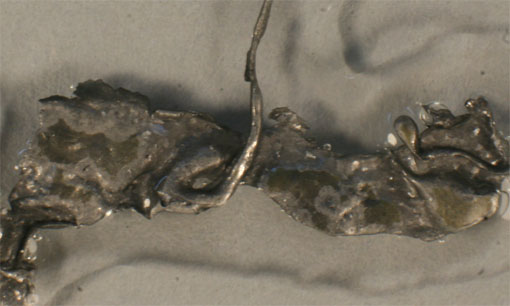
Fig.11

Fig.9

Fig.8
La fotografía de la figura 6, se ha tomado 90 minutos después.
Si la reacción del ácido nítrico concentrado se realiza sobre granos de plomo, la apariencia es distinta, ya que en este caso son los gránulos los que se recubren de la película blanca (fig. 7-9).Las fotografías se toman en un intervalo de 30 minutos

Fig.6
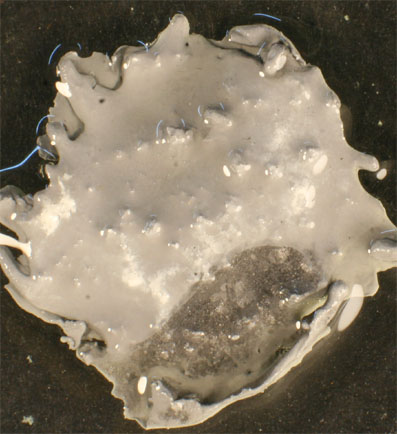
Fig.5
Fig.3

Fig.7

Fig.1