
Fig.30
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
2.REACCIÓN
DEL ÁCIDO NÍTRICO 13M CON HIERRO
2.1. Reacción con clavos de hierro
Comenzaremos en nuestra parte
experimental operando como de costumbre, con una gota de ácido nítrico 13M,
y clavo de hierro, de 2 cm. de longitud. Como se ve (fig.16, sobre 5mm de
clavo), se realiza violentamente (el ácido está muy concentrado), transcurriendo
en 20 segundos y la reacción redox dominante, implica la producción de dióxido
de nitrógeno de color marrón rojizo. También aparecerá coloración amarilla,
producida al disolverse el dióxido de nitrógeno en el ácido nítrico.
REDUCC: 12HNO3 + 6e- = 6NO2 + 6H2O + 6NO3 -
OXIDAC: 2Fe - 6e = 2Fe3+
__________________________________________________
12HNO3 +2Fe =
2Fe(NO3)3 + 6NO2 (gas) + 6H2O
Sin embargo ya se ha explicado en etapas anteriores que en las reacciones con ácido nítrico, se producen reacciones secundarias y terciarias, dando lugar a otros gases, aunque la dominante si el ácido está muy concentrado es la mencionada. El segundo gas desprendido es el óxido de nitrógeno(II), según reacción ya explicada. La secuencia fotográfica presentada figs. 16-20, se realiza en 20 minutos. En la 20 se observa ya el pasivado del clavo, que se recubre de una película.

Fig.30

Fig.17 (ampliación)

Fig.28

Fig.19 (ampliación)

Fig.29
2.2.Ácido nítrico 13M, con virutas de hierro.
La reacción es completamente diferente a la anterior. Apenas aparecen unas burbujas (figs. 28-29) que enseguida cesan, formándose la película protectora (fig.30 y 31).

Fig.27
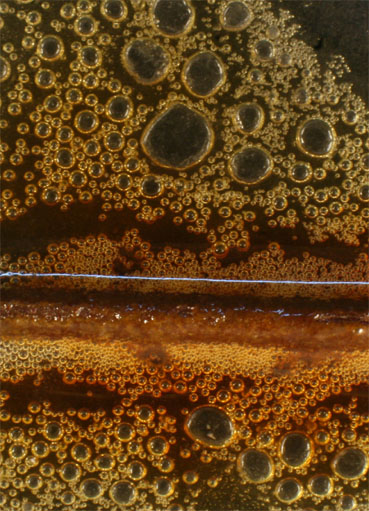
Fig.26

Fig.25

Fig.24
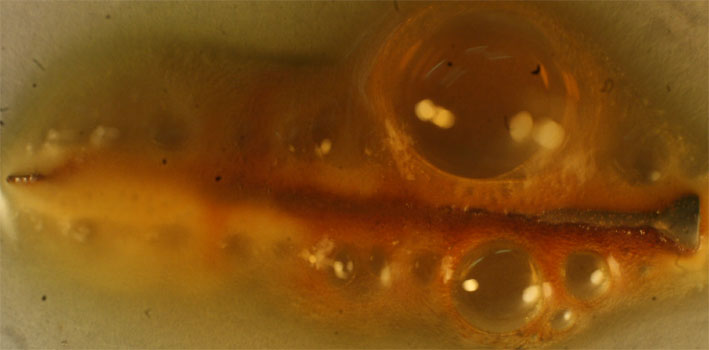
Fig.22
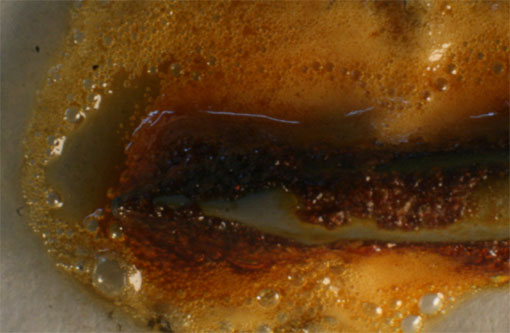
Fig.21

Fig.20
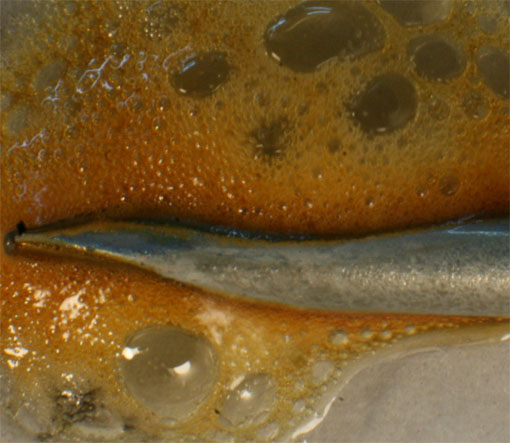
Fig.18
Fig.23

Fig.31

Fig. 16