
Fig.15
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
Ácido nítrico sobre cobre (II) (continuación)
Continuamos la
reacción química empleando HNO3, 3,5M. (fig.14).
Las burbujas de NO, empiezan a aparecer al cabo de 13 minutos (fig.15). Las
siguientes fotografías, son sucesivas (las burbujas se van haciendo mas grandes)
fig. 16,17 y 18. Al cabo de 30 minutos comienza a aparecer el color azulverdoso
debido al aumento de concentración del
ion complejo [Cu(H2O)4]2+, formado.(fig. 19 y 20)

Fig.15

Fig.14

Fig.16

Fig.17

Fig.18

Fig.19

Fig.20
Como a partir de los 50 minutos casi no hay reacción, se calienta el ácido (fig.19).
La fotografía de la fig. 20, se
hizo después de una hora, observándose
la lámina desgastada.
Con HNO3, 1,5M. (fig.21). Las
burbujas de NO, empiezan a aparecer al cabo de 18 minutos (fig.22). Las siguientes
fotografías , son sucesivas ( las burbujas se van haciendo mas grandes, quedándose
pegadas al metal) fig. 23 ( ampliación) y 24. Al cabo de 60 minutos comienza
a aparecer el color azulverdoso debido al aumento de concentración del ion complejo (fig.25). La última foto se
realizó a los 90 minutos.

Fig.21

Fig.22

Fig.23. Ampliación

Fig.24
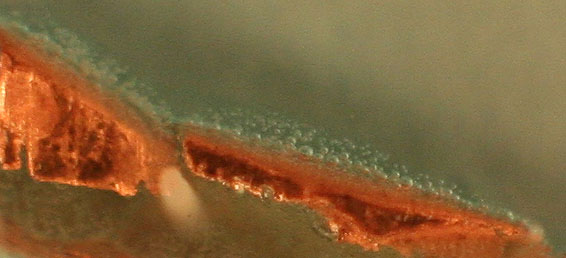
Fig.25
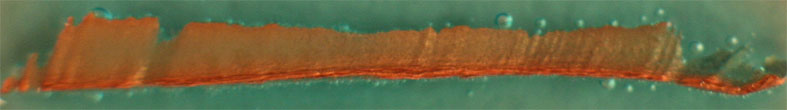
Fig.26
Con HNO3, 0,5M. (fig.27). Las
burbujas de NO, comienzan a aparecer al cabo de 70 minutos (fig.28). La siguiente
fotografías, es sucesiva (fig.29). Las burbujas permanecen pegadas al metal.
Después de calentar la disolución comienza a aparecer el color verde azulado,
a los 75 minutos del comienzo de la reacción (fig.30).

Fig.27

Fig.28

Fig.29

Fig.30