
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
Ácido
nítrico y cobre (primera parte)
La mayoría de los metales son
atacados por el ácido nítrico. Son excepciones el platino, el iridio, rodio,
tántalo y oro. En dichas reacciones se pueden producir no solamente los óxidos
del nitrógeno (I),(II) y (IV), sino también nitrógeno libre, hidroxilamina
e incluso amoniaco; son reacciones redox características, pero con unos mecanismos
bastante complejos
[1]
.
La reacción con el cobre, con
la cual vamos a comenzar, es la históricamente empleada por Priestley en 1772,
para obtener los óxidos de nitrógeno. Sin embargo esta reacción produce resultados
diferentes según la concentración del ácido nítrico, y la temperatura, como
veremos en nuestras prácticas de química a la gota.

a) Con Nítrico 13M
Comenzaremos con una disolución
de ácido nítrico 13M (su máxima con-centración), en la caja petri, actuando
sobre una viruta de cobre de 1cm de longitud (fig.1). Al ponerse en con-tacto
rápidamente reacciona produ-ciendo dióxido de nitrógeno, en unas grandes burbujas
pardas de dióxido de nitrógeno (fig.2).

La reacción redox sin considerar
los procesos intermedios posibles, sería:
REDUCC: 4HNO3
+ 2e- = 2NO2
+ 2H2O + 2NO3
-
OXIDAC: Cu
- 2e = Cu2+
______________________________________________
4HNO3
+Cu =
Cu(NO3)2 + NO2 (gas) + 2H2O
La reacción continua, como se aprecia en las figuras 3, 4 (ampliación), 5 de forma intensa.

Fig.3

Fig.4 (ampliación)

Fig.5
Las últimas fotos (fig. 6 y 7)
se hacen a los 10 minutos de la puesta en contacto del cobre con el ácido
nítrico. Posiblemente las burbujitas mas finas que se observan puedan proceder
de la producción de óxido de nitrógeno(II), incoloro, menos soluble en el
agua
Según el proceso global:
REDUCC: 8HNO3 + 6e- = 2NO + 4H2O + 6NO3 -
OXIDAC: 3Cu - 6e- =
3Cu2+
__________________________________________________
8HNO3
+3Cu = 3Cu(NO3)2 + 2NO (gas)
+ 4H2O
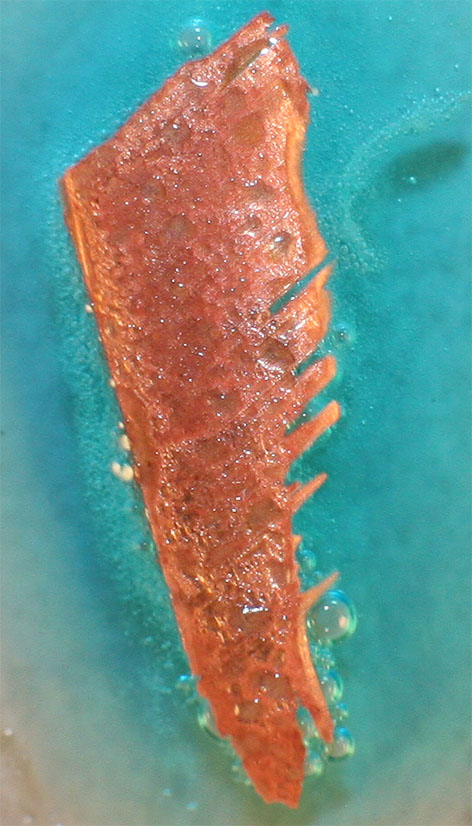
Fig.6
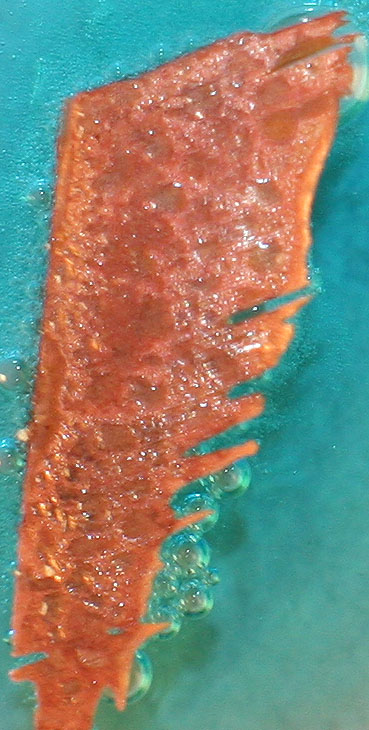
Fig.7
b) con Nítrico 6,5M
Se repite la reacción con otro trozo de cobre y ácido nítrico 6,5M..La viruta de cobre tiene una longitud de 8 mm. Debe recordarse que la viruta va girando por efecto de las burbujas de gas.
Tarda 5 minutos
para que comiencen a aparecer burbujas (debe recordarse que con concentración
doble aparecían inmediatamente), y tarda 10 minutos en notarse verde azulada
la disolución. Los procesos redox a tener en cuenta son los anteriores, pero
con mayor predominio del segundo.
La sucesión de
fotos desarrollada durante 20 minutos es la siguiente (figs. 8, 9, 10 y 11)

Fig.8

Fig.9

Fig.10

Fig.11
A la media hora la laminilla de cobre aparece casi desgas-tada (fig.12),y la disolución completamente verdosa

[1] Se ha sugerido (Hedges,1930), que siempre tiene lugar una reacción primaria, con producción de hidrógeno naciente, que a su vez reduciría al ácido nítrico, hasta formar productos como la hidroxilamina, el amoniaco, y los ácidos nitrosos e hiponitroso, que a su vez reaccionarían con el ácido nítrico dando lugar a los productos que fundamentalmente se recogen: los óxidos de nitrógeno(I), (II) y (IV).