ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
1) PERMANGANATO CON SULFITO SÓDICO EN MEDIO
BÁSICO
Se disponen las gotas de permanganato potásico
con sulfito sódico(s) en medio
básico (KOH 6N)
Se repite el proceso de anteriores prácticas, obteniéndose la siguiente sucesión fotográfica en el intervalo de 1 minuto.
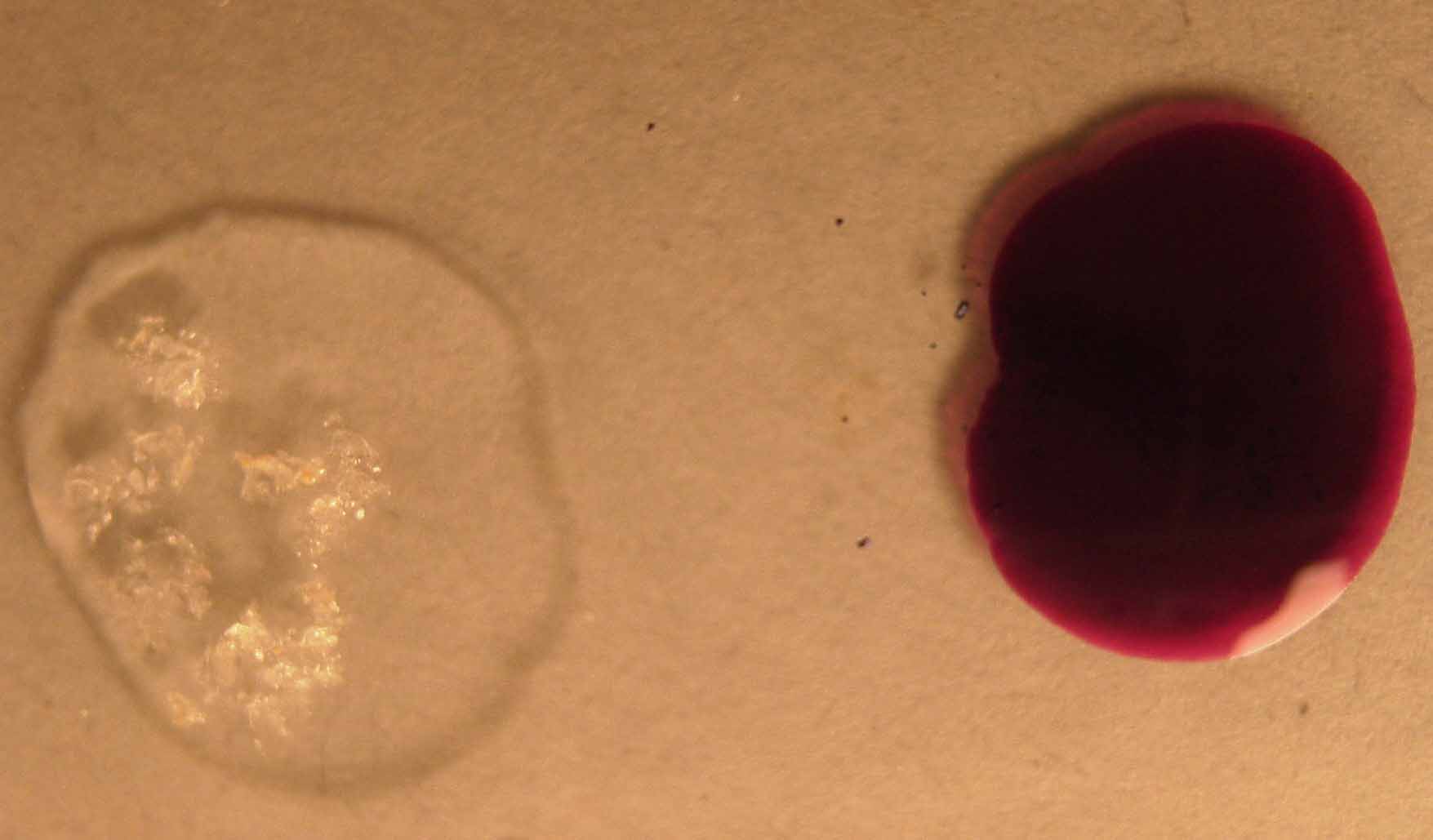
foto 1
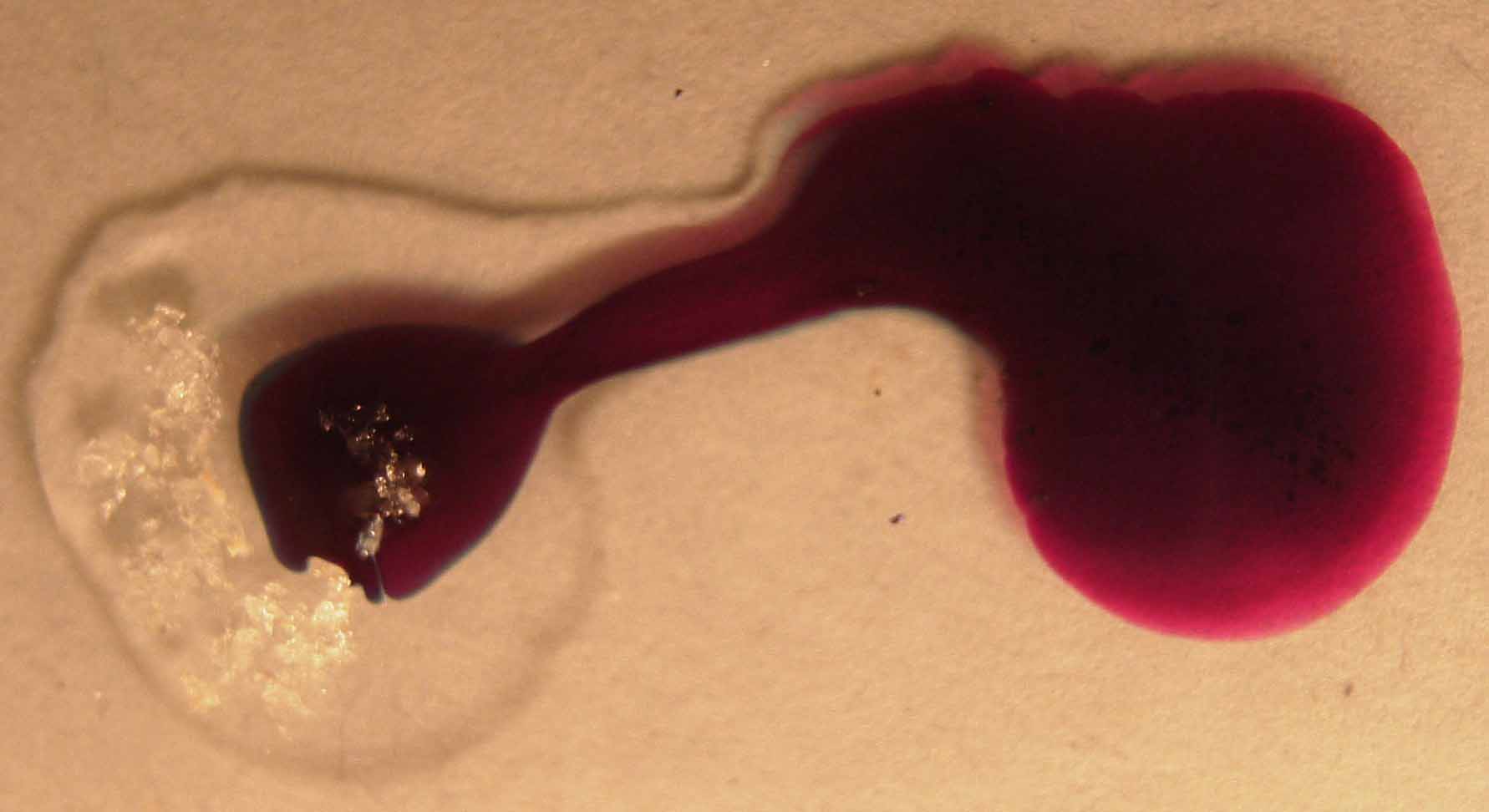
foto 2
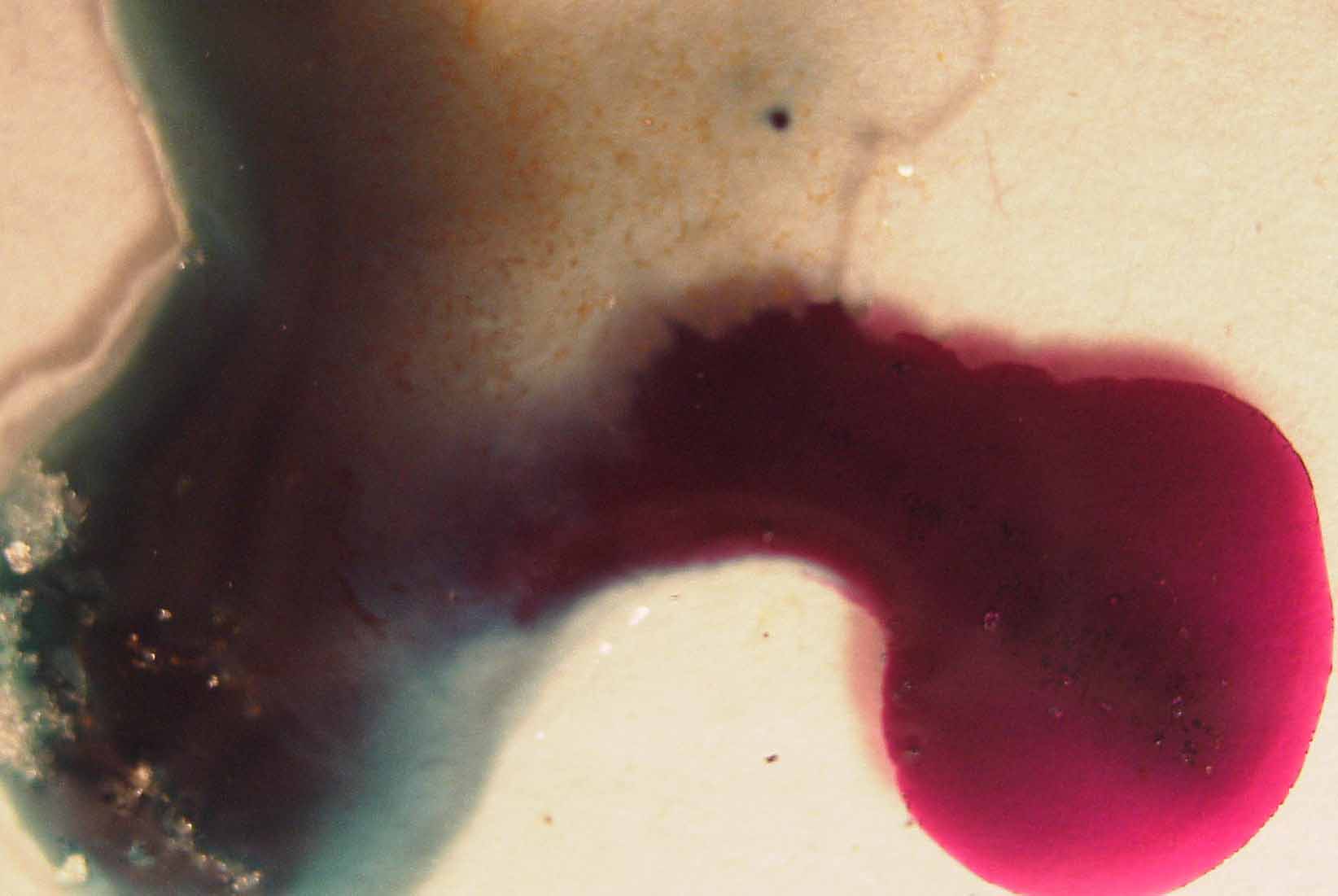
foto 4
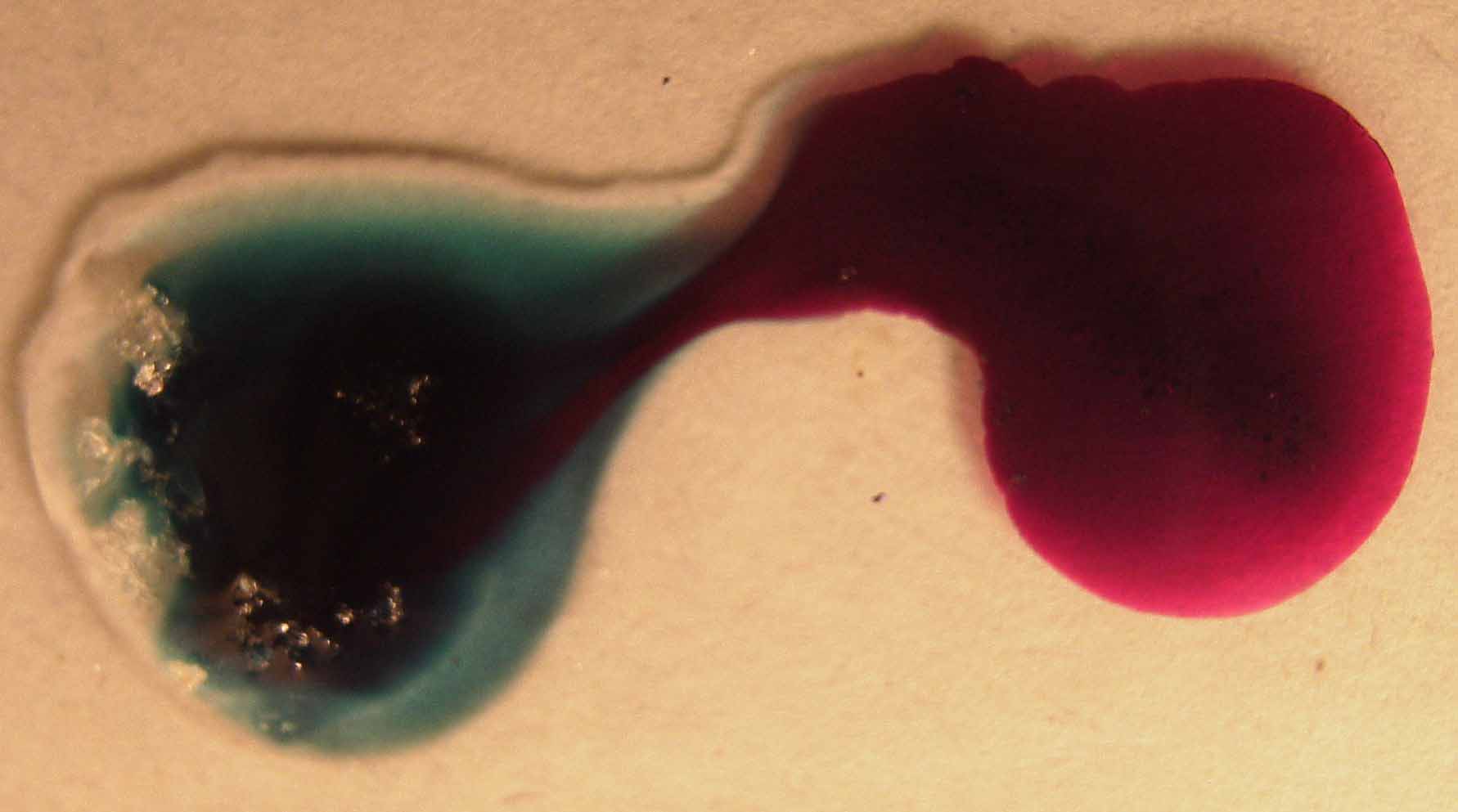
foto 3
Parece evidente la formación rápida de manganato
verde y la aparición final de un
precipitado marrón oscuro de dióxido de manganeso y pequeños copos más
claros de hidróxido de manganeso(II) al agregarse unas gotas de agua destilada
para aumentar la extensión de la gota, lo que permitirá diferenciar las
zonas reactivas.
Los posibles procesos químicos que justificarían la aparición de los colores que se aprecian, serían:
REDUCC. 2KMnO4 +2K+ +2e- = 2K2MnO4
OXIDAC: Na2SO3 + 2OH- -2e- = Na2SO4 + H2O
__________________________________________________________
2KMnO4 +2KOH +Na2SO3
![]() 2K2MnO4
+ Na2SO4 + H2O
2K2MnO4
+ Na2SO4 + H2O
2) Permanganato con sulfito sódico 2%, en medio fuertemente básico (KOH
50%).
La sucesión fotográfica sería la dada, teniendo en cuenta que la última fotografía se realizó varias horas más tarde.
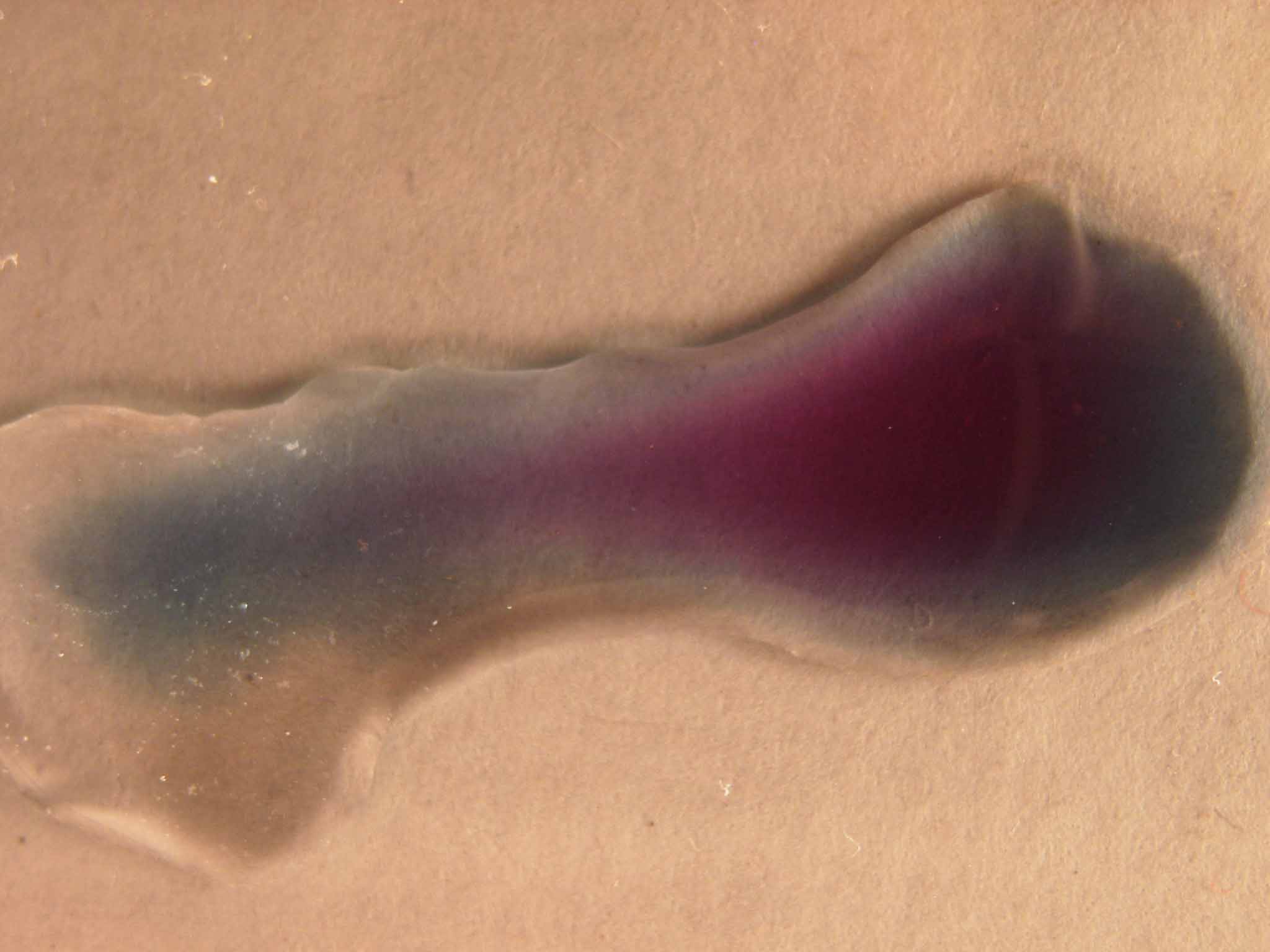
foto 1
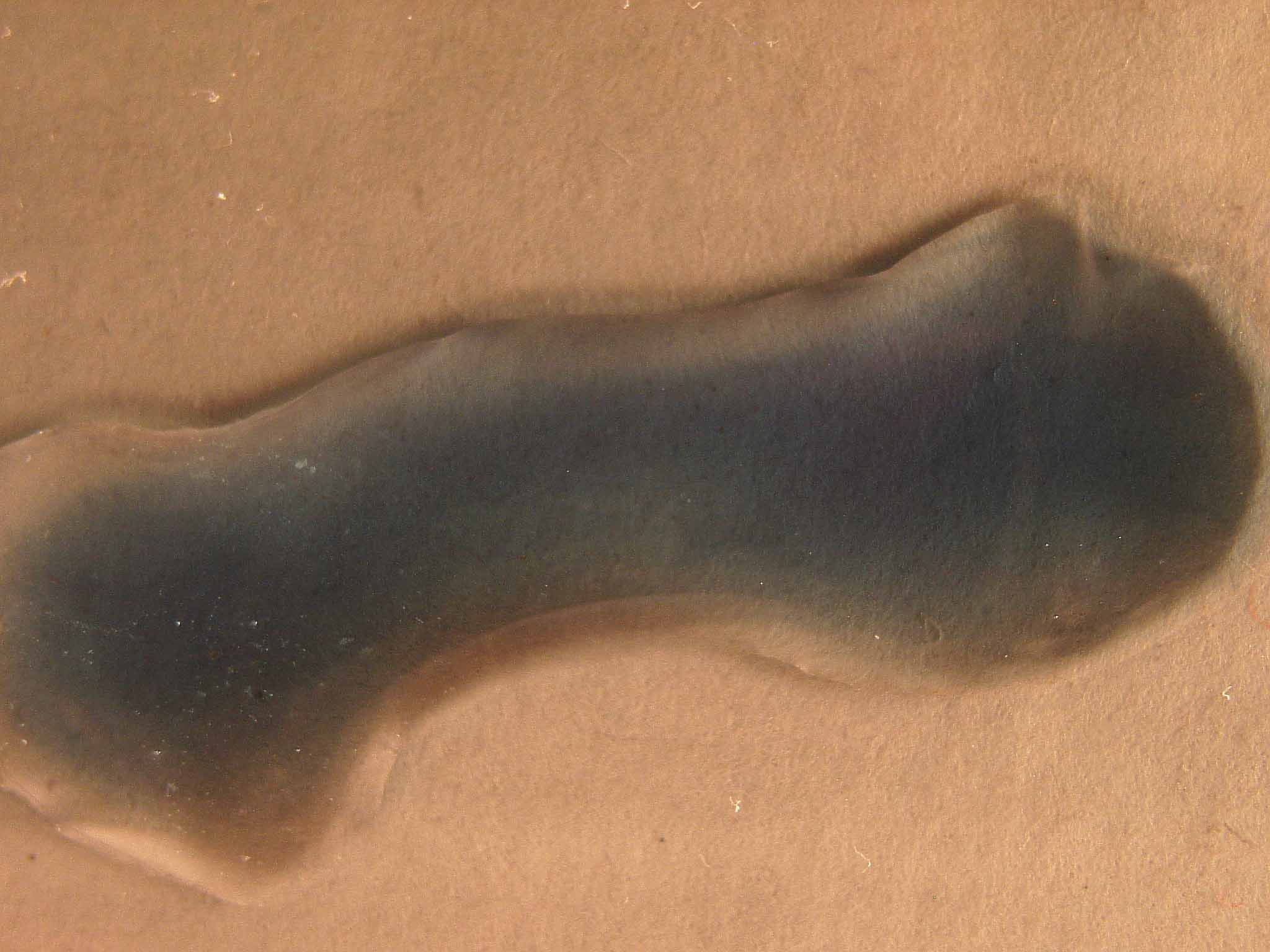
foto 2

foto 4
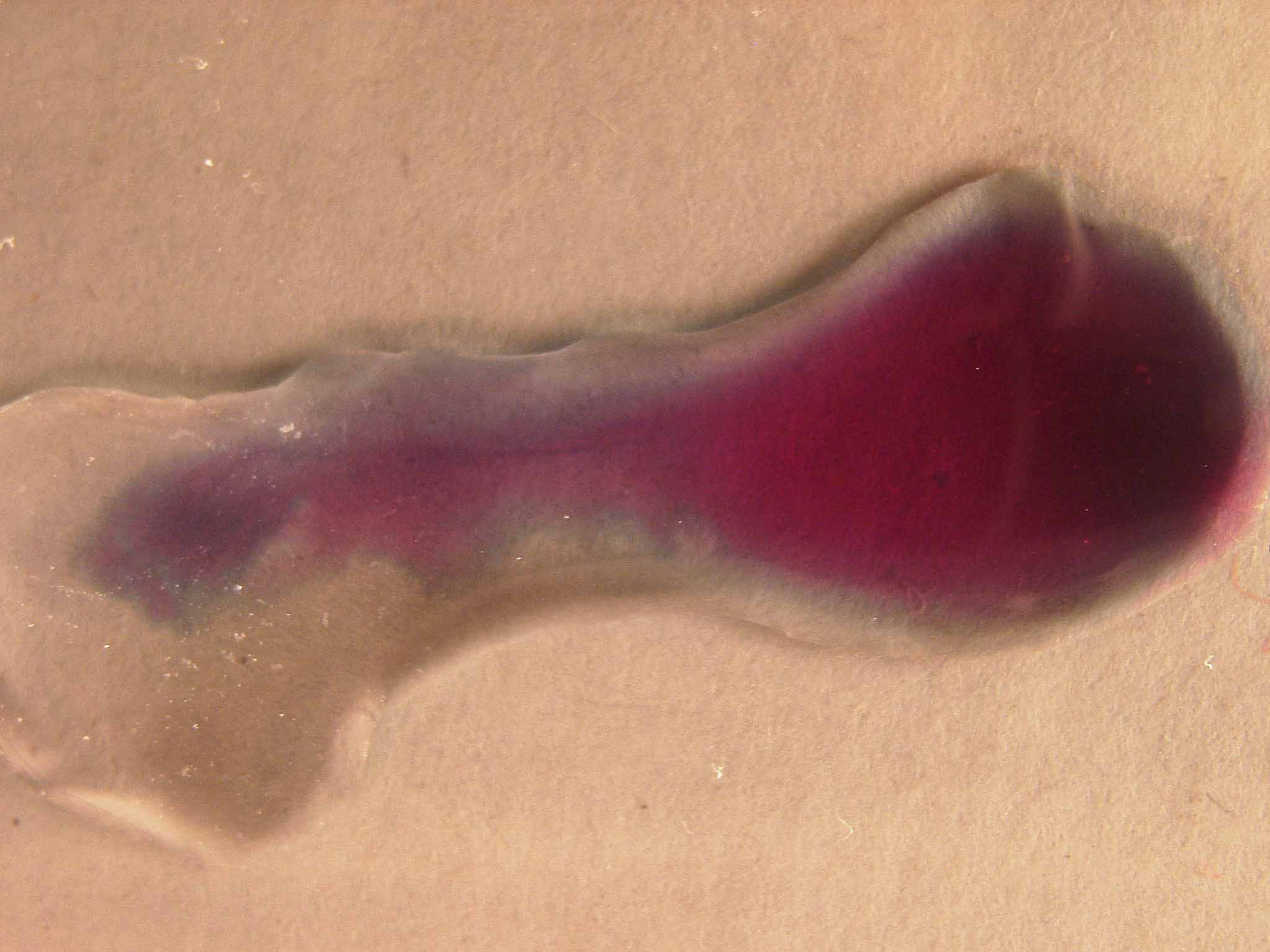
foto 3
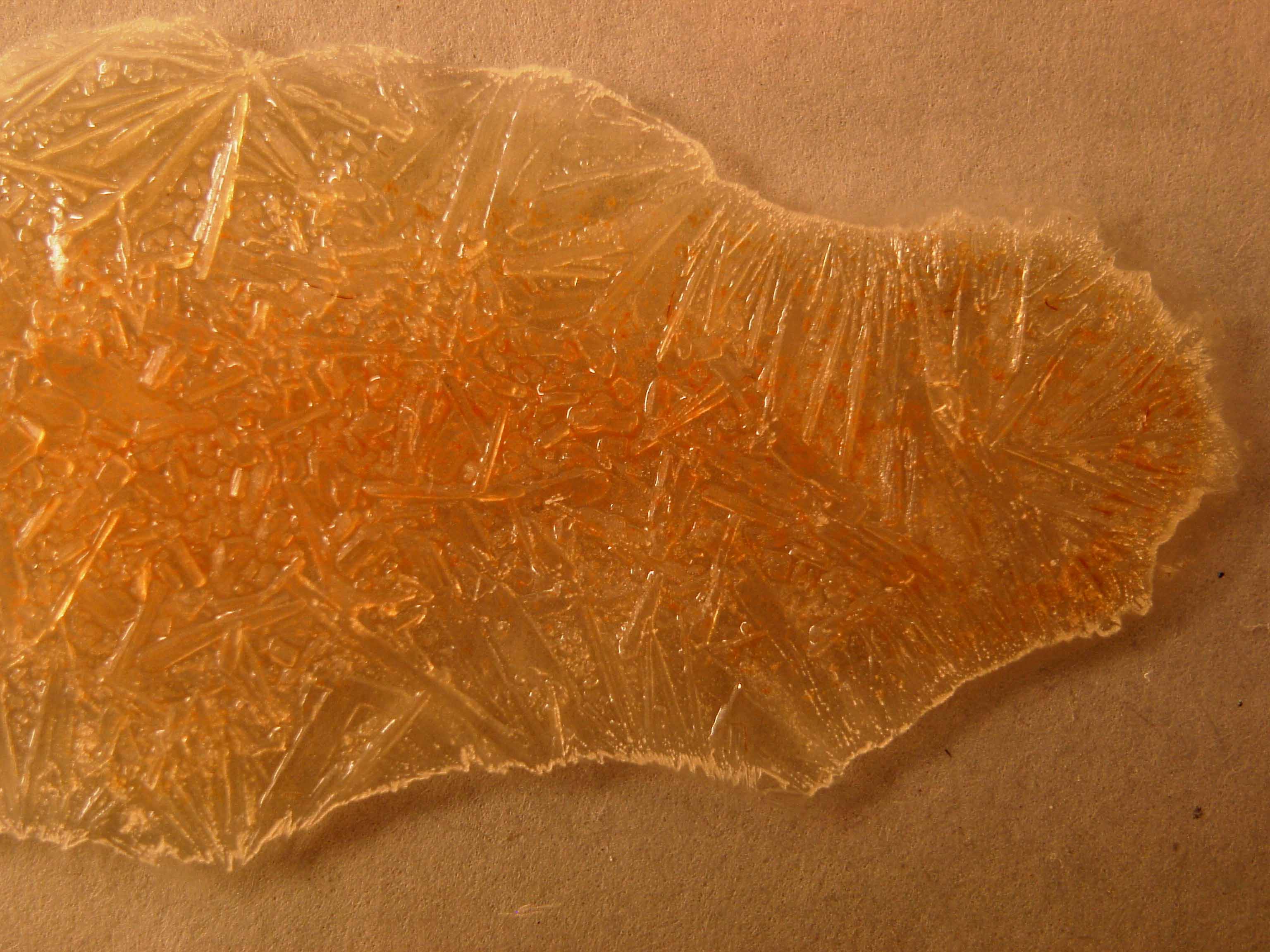
foto 5
En la primera fotografía se observa la aparición
del hipomanganato azul diferente de la tercera fotografía en la que surge
el tono verdoso procedente del manganato, que al cabo de algún tiempo
va reduciéndose a los hidróxidos de manganeso responsables del color de la última fotografía. En las dos primeras
fotografías se aprecian pequeñas burbujas absorbidas en el medio especialmente viscoso; deberá ser el oxígeno
procedente de la oxidación de los OH- del medio.
REDUCC: 2MnO4 - +4e-
= 2MnO4
3-
OXIDAC: 4OH- - 4e = O2 + 2H2O
_________________________________________
2KMnO4 +4KOH
![]() 2K3MnO4
+ O2 + 2H2O
2K3MnO4
+ O2 + 2H2O
EB= -0,4V pH muy alto
Debe tenerse en cuenta que el hipomanganato
es muy inestable, y a temperatura superior a 10ºC, se desproporciona en
Mn6+ y Mn4+, por eso para inciar esta reacción hay
que tener previamente los reactivos en la nevera, o incluir hielo en la caja petri (aún así el color azul sólo dura
pocos segundos).
También se podría producir:
REDUCC. 2KMnO4 +2Na+ +2e- = 2K2MnO4
OXIDAC: Na2SO3 + 2OH- -2e-
= Na2SO4 + H2O
_____________________________________________________________
2KMnO4 +2KOH +Na2SO3
![]() 2K2MnO4
+ Na2SO4 + H2O
2K2MnO4
+ Na2SO4 + H2O
REDUCC: 2MnO4 2- + 4H2O+4e-
= 2MnO2 + 8OH-
OXIDAC: 4OH- - 4e = O2
+ 2H2O _________________________________________________
2K2MnO4 +2H2O
![]() 2MnO2 + O2
+ 4KOH
2MnO2 + O2
+ 4KOH
2MnO4 2- +2H2O ![]() 2MnO2 + O2 + 4OH-
2MnO2 + O2 + 4OH-
REDUCC: MnO4 2- + 4H2O
+ 4e- = Mn2+ + 8OH-
OXIDAC: 2Na2SO3 + 4OH- -4e-
= 2Na2SO4 + 2H2O
________________________________________________________
K2MnO4 + 2Na2SO3
+ 2H2O![]() Mn (OH)2 + 2Na2SO4 + 2KOH
Mn (OH)2 + 2Na2SO4 + 2KOH
MnO4 2- + 2SO3
2-+ 2H2O ![]() Mn2+ + 2SO4 2-+ 4OH-
Mn2+ + 2SO4 2-+ 4OH-