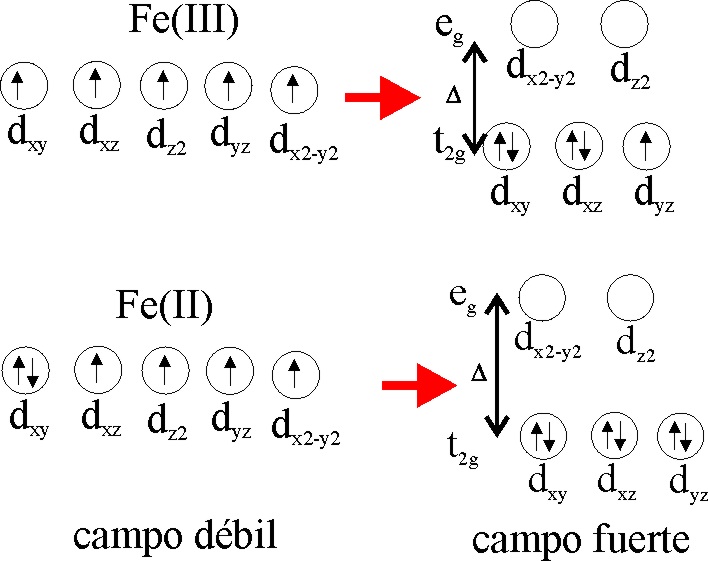
Fig.1
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
Complejos del Hierro
(Primera parte)
Los compuestos de coordinación del Fe(II) y Fe(III), son muy conocidos, pues quizá fueran los primeros complejos empleado comercialmente, que dieron lugar a nombres de otros compuestos químicos como el ácido prúsico, azul de prusia etc [1] , y por otra parte son indispensables para la vida humana, porque gracias a ellos se puede transportar el oxígeno a los diferentes tejidos [2] .
El Fe(III),
dispone sus 5 electrones desapareados, en los 5 orbitales atómicos d, con
la máxima multiplicidad de espín, mientras que el Fe(II), surgiría con un
par de electrones en un orbital d y cuatro mas, sin pareja.

Fig.1
Si los ligandos son de campo débil, provocan un pequeño desdoblamiento, el complejo será de alto espín , como ocurre con el agua, o los halógenos (F, Cl).Sin embargo con ligandos de campo fuerte, esto es aquellos ligandos que interaccionan fuertemente con el elemento central, estos electrones se agrupan en los 3 orbitales de menor energía (t2g), quedando un electrón sin pareja, en el caso del Fe(III) (fig.1) . El desdoblamiento de estos grupos de orbitales atómicos t2g y eg, en función de la interacción con los ligandos, grupos con pares de electrones solitarios, permite saltos electrónicos por absorción de energía luminosa en el espectro visible, que provoca que el compuesto tome colores complementarios espectaculares, muy apropiados para ser visionados en foto digital. Los complejos del hierro, siempre tienen estructura octaédrica [3] , con 6 puntos de coordinación.
La serie espectroquímica de Tsuchida,
clasifica los ligandos por su interacción con los iones centrales, en este caso el Fe(III), sería I- <Br-<Cl-<F-<
R-OH< H2O< NCS-<NH3<CN-
Cuanto mayor sea la interacción con los orbitales d, según su orientación espacial, será mayor el desdoblamiento entre niveles, y por lo tanto, mayor será la diferencia energética ), mayor la frecuencia L de la radiación absorbida, menor su longitud de onda 8. En función de eso la radiación absorbida, los colores que se observan vienen dados en la tabla 1.

Tabla 1
Sin embargo mientras los complejos de alto espín del hierro(III), son incoloros, o con colores pálidos, los que forma con ligandos de campo fuerte como el tiocianato o el cianuro, dan lugar a colores muy intensos. Ello es debido a otro efecto que se superpone con el anterior. Existe una transferencia de carga del ligando, al ion central, Fe(III), con captura de un electrón por parte de éste y reducción a Fe(II). Este hecho es el que hace que los colores sean especialmente vistosos.
Para nuestra seccción tomaremos nitrato de hierro(III) cristalizado disolviéndolo en una gota de agua, con una coloración ligeramente amarilla, debido a la hidrólisis del complejo
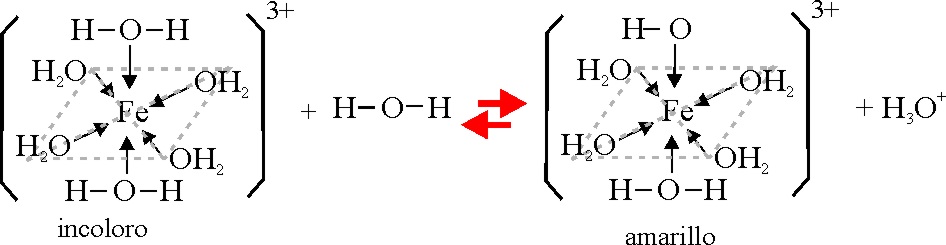
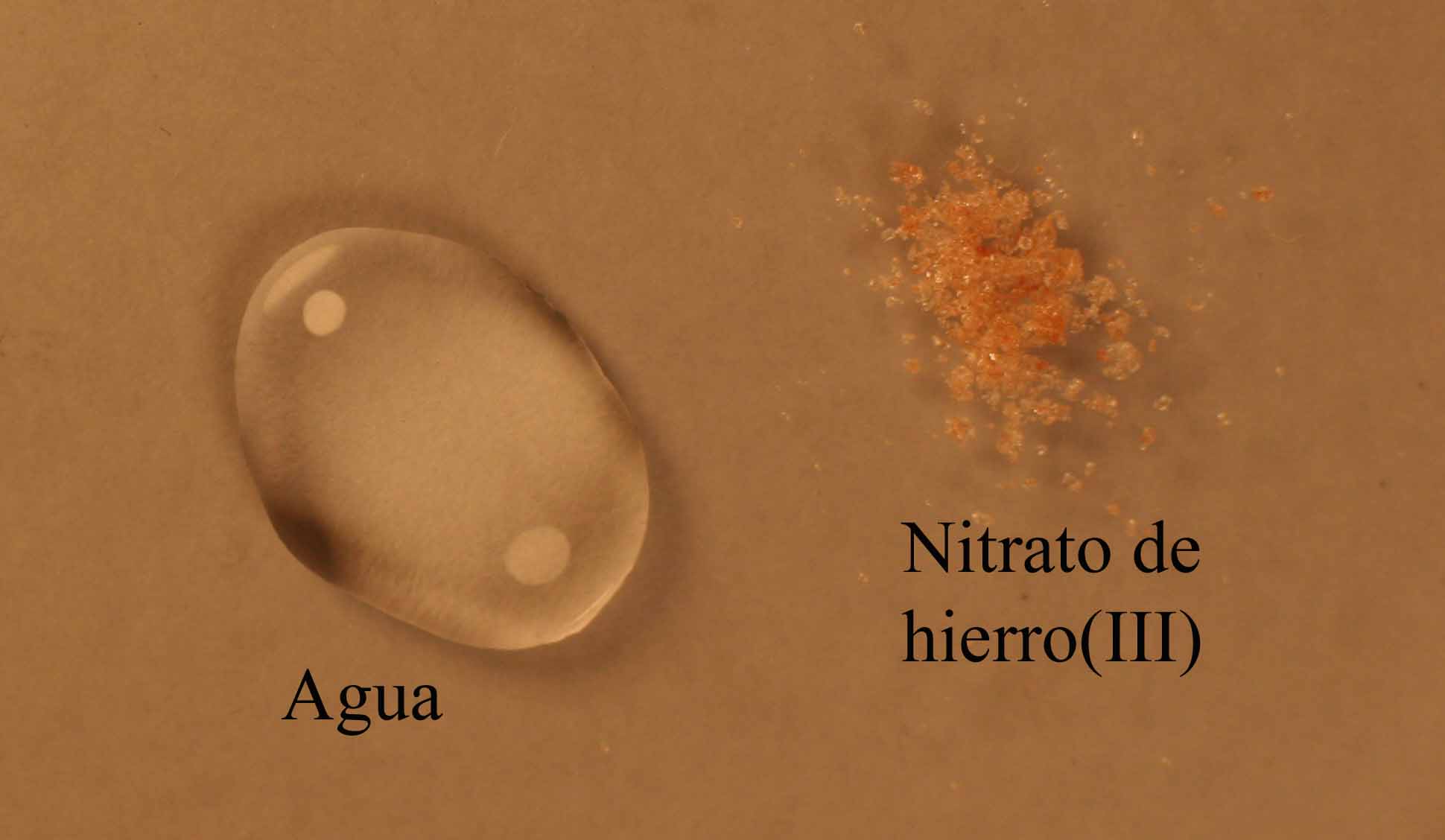
Fig.2
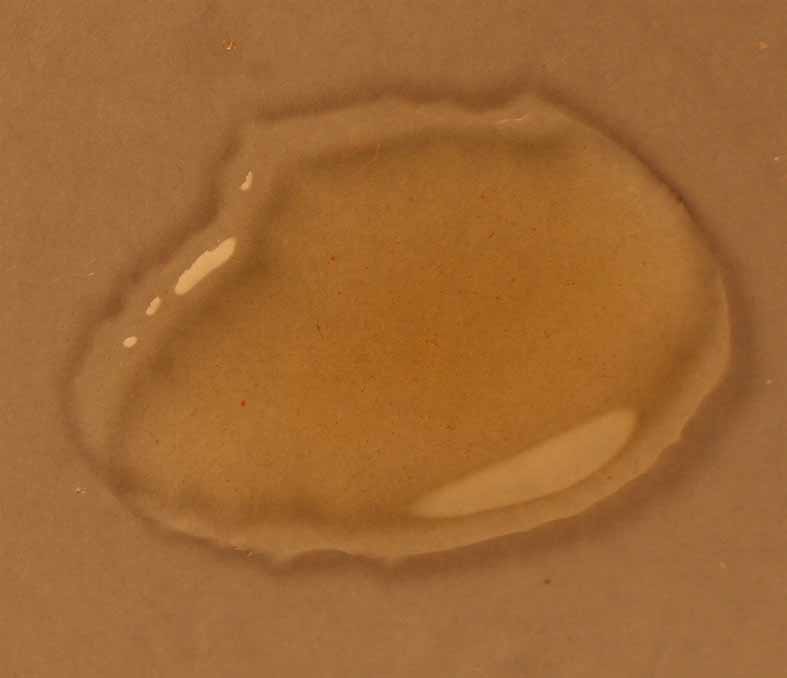
Fig.3
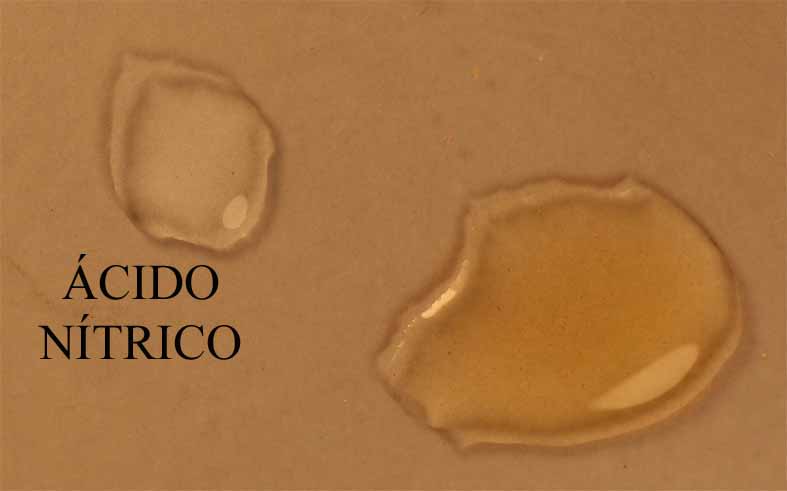
Fig.4
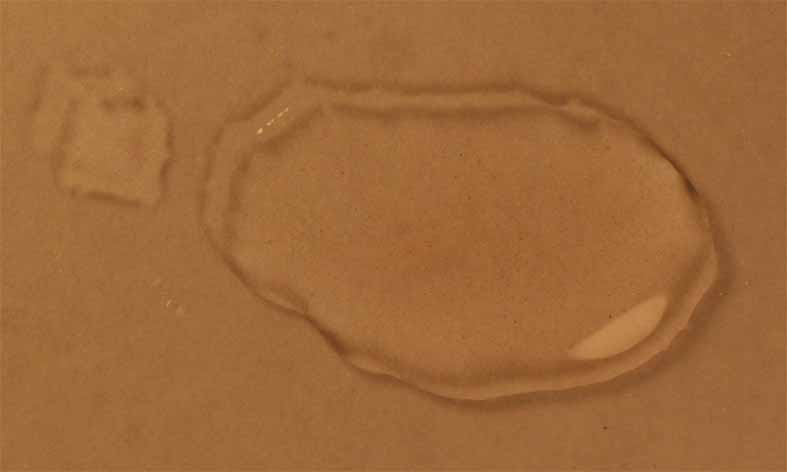
Fig.5
Si se agrega NaCl(s), otra vez amarillea, por sustición de un ligando H2O por cloro. La adición de ortofosfato, hace desparecer el color, por sustitución del ligando Cl por dihidrógeno ortofosfato.
Si agregamos NaOH
6N, aparece un precipitado marrón de hidróxido de hierro(III) que se disuelve al agregar otra vez ácido nítrico
concentrado, según los procesos:

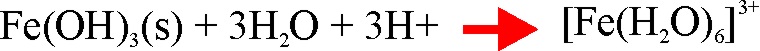
Los ensayos
a la gota, se reproduce en las fotografías de las figuras 6, 7 ,8 y 9
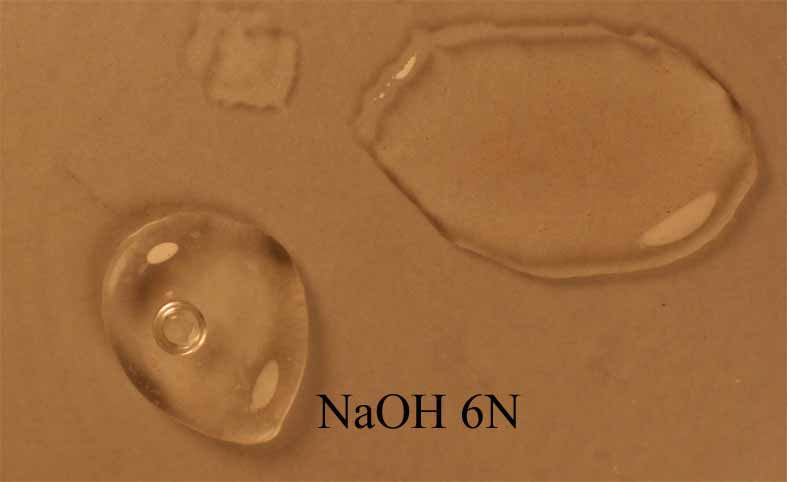
Fig.6
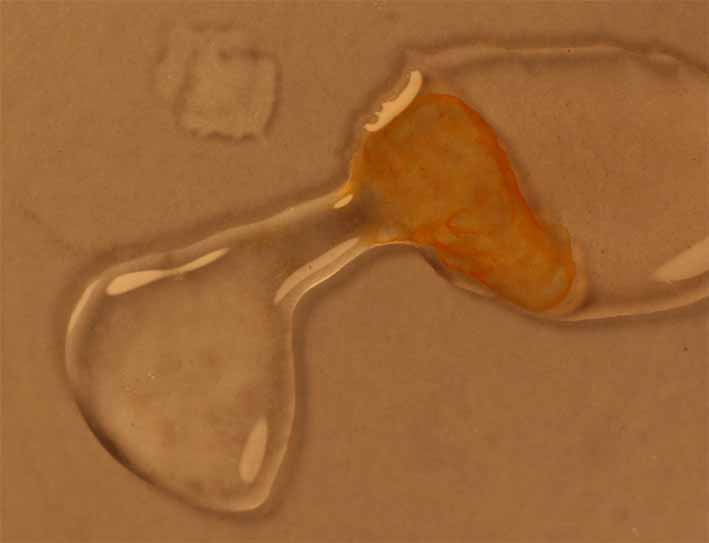
Fig.7
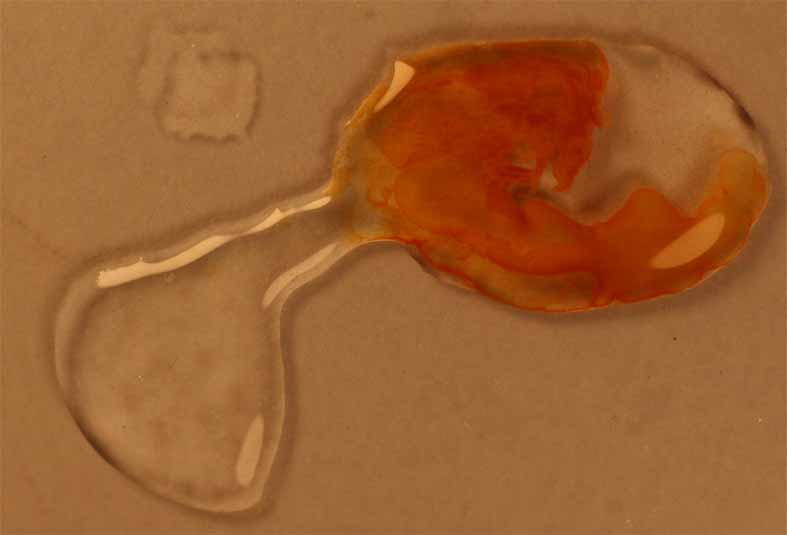
Fig.8
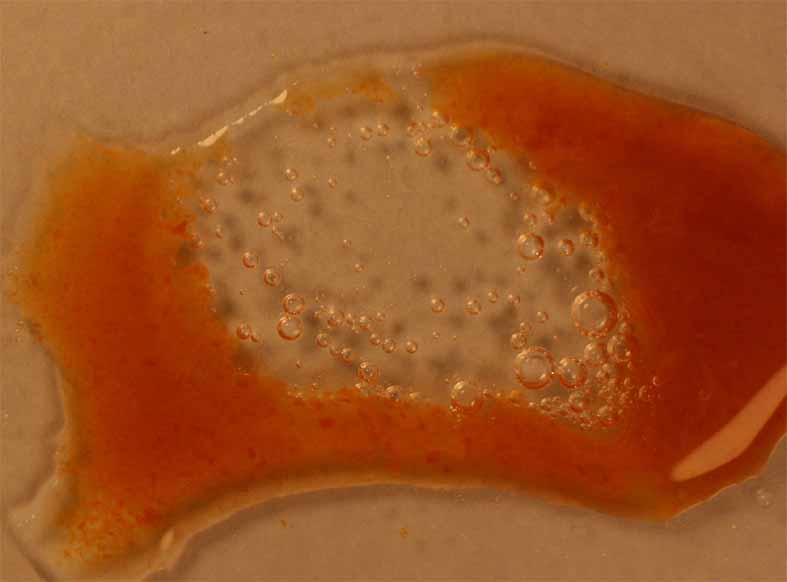
Fig.9
Como se aprecia en la fig 9, la
adición de ácido nítrico concentrado, no sólo disuelve el precipitado, sino
que produce un proceso redox con el agua, con desprendimiento de gases, ya
de NO2 y N2O4, ya de O2
.
Si se agrega tiocianato potásico,
se sustituye un ligando acuo por tiocianato, produciéndose una intensa coloración
roja (“sangre de toro”), debido
a una banda de absorción entre 445 y 450nm
[4]
.
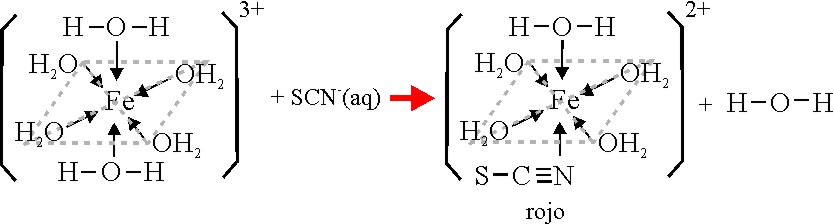
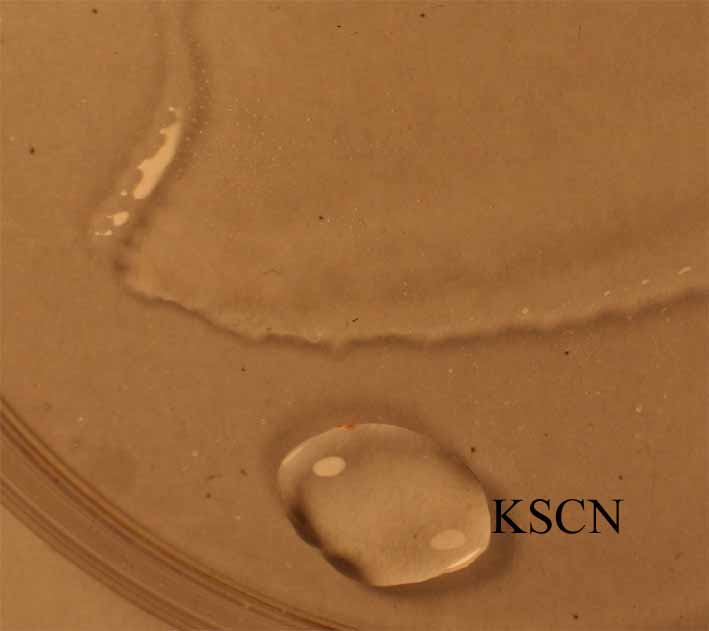
Fig.10
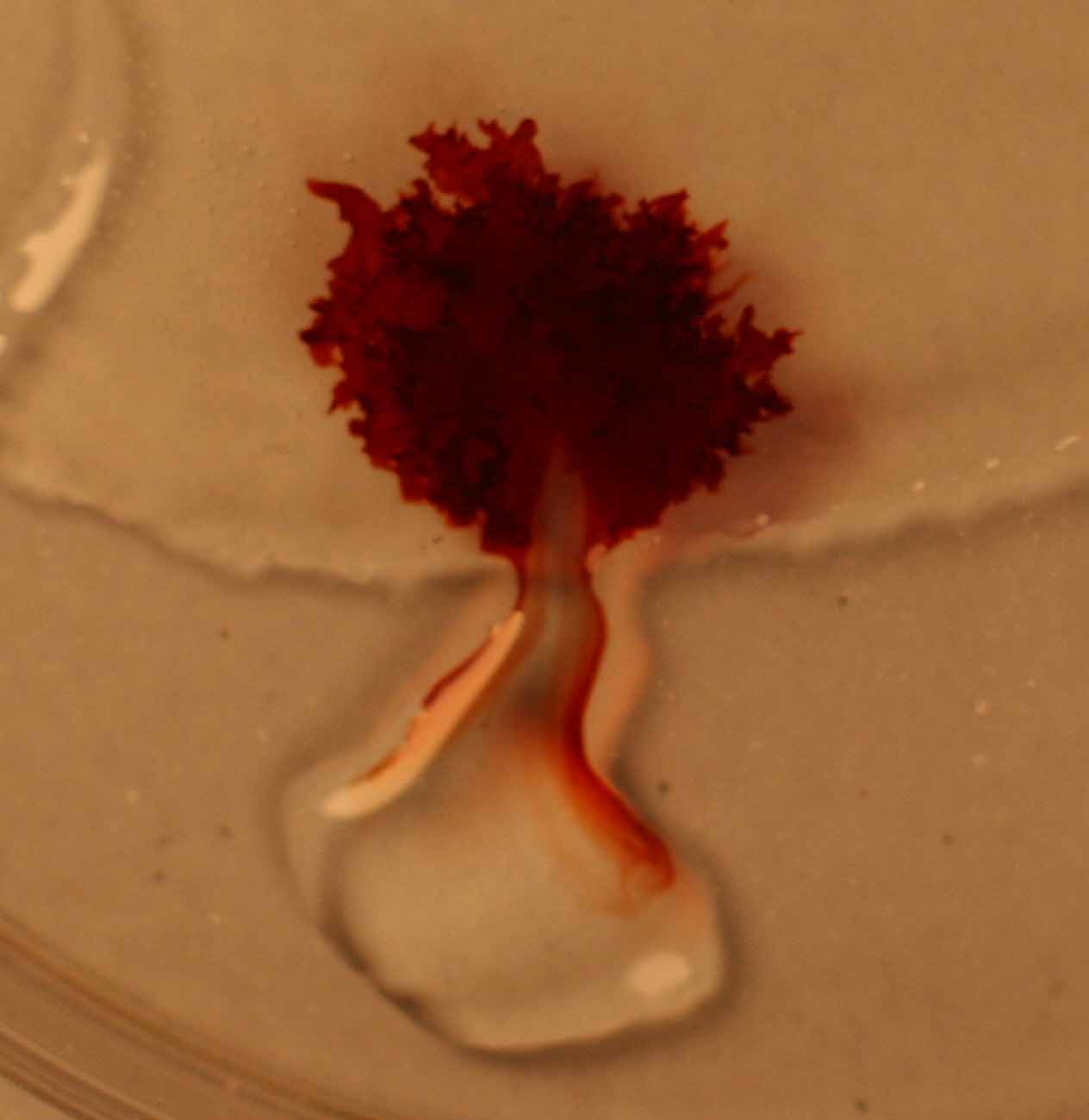
Fig.11
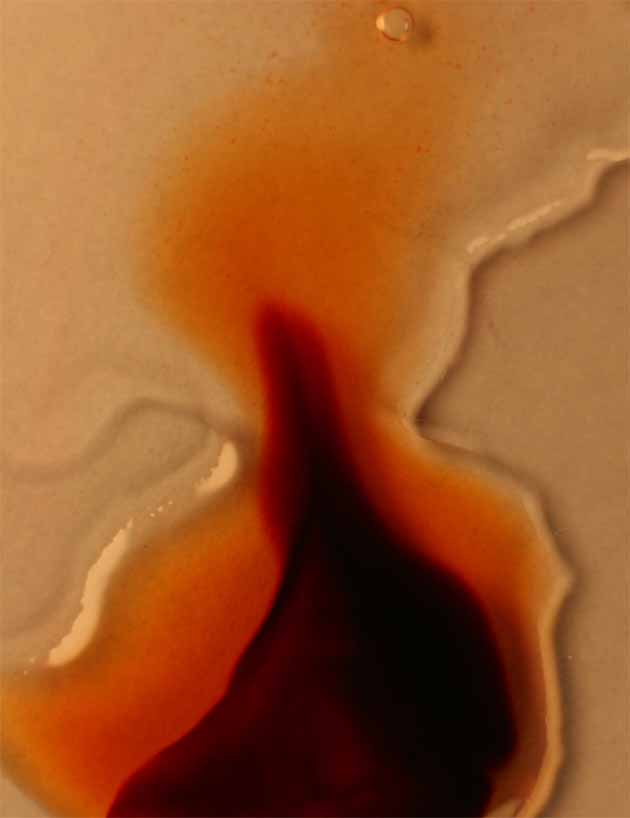
Fig.12
Sin embargo este complejo coloreado se puede volver incoloro tratándolo con NaF, ya que se sustituye el ligando SCN- pasando a otro tipo de complejo (complejo de alto espín), ya que el F-, como se observa en la serie espectroquímica, es un ligando de campo débil, que casi no desdobla los niveles.
Las fotografías del proceso se dan en las figuras 13 y 14
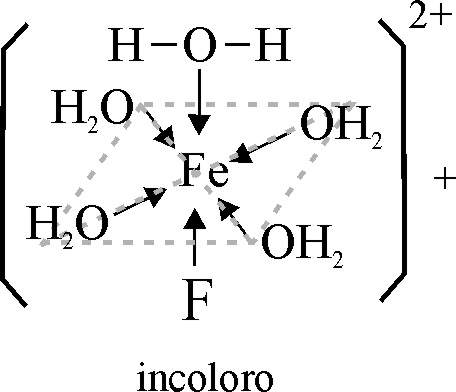

Fig.13
Fig.14
[1]
Dicho compuesto
se describió por primera vez en la Miscellania Berlinensia, en 1710, habiendo
sido obtenido por el tintorero berlinés Diesbach, al querer preparar
una “laca de cochinilla”, con una potasa fabricada por Dippel,
en la purificación del aceite animal que llevaba su nombre (oleum animale
Dippeli), de ahí el nombre de “azul de Prusia” o “azul de Berlin” (el
actual ferrocianuro potásico). Posteriormente Macquer lo bautizaría como
sal lixivial de la sangre, y así aparece en la primera enciclopedia química
que éste escribiera.
[2]
El oxígeno es
transportado por la mioglobina o por la hemoglobina de la sangre, como
un ligando coordinado al Fe(II), en la oximioglobina
y en la oxihemoglobina, que le reserva un punto de coordinación suficientemente
protegido, para que no se produzca la oxidación a Fe(III).
[3]
A veces el sexto punto de coordinación está
vacío como ocurre en la mioglobina y en la hemoglobina.
[4]
La sustitución
de otro ligando acuo por tiocianato, no modifica el color