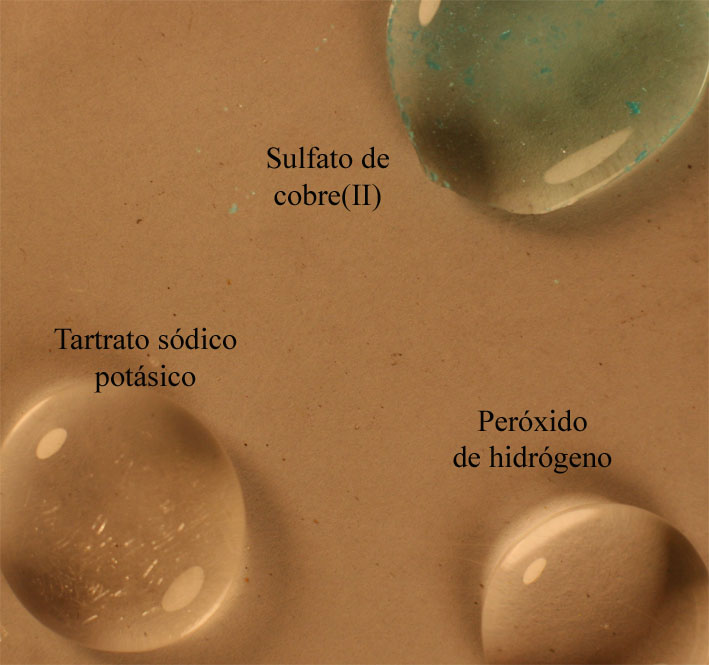
Foto 1
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
Descomposición catalítica del
peróxido de hidrógeno 4
Estudio de un caso particular: Actuación redox
del Cu2+ como catalizador.
Aunque ya se ha estudiado
la descomposición catalítica del peróxido de hidrógeno, con iones Fe3+,
Mn4+, y Cu2+. Se van a interpretar una serie de fenómenos
secundarios que ocurren en la doble descomposición redox, del tartrato y del
peróxido de hidrógeno.
Para ello se disponen
como se costumbre, 3 gotas, en una caja petri, tal como se aprecia en la foto
1

Foto 1

Foto 2
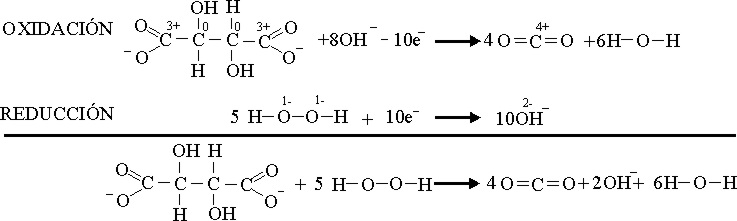
El proceso
redox anterior no se realiza totalmente, sino a través de varios pasos sucesivos
en los que tartrato va perdiendo carbonos
y formando dióxido de carbono
Sin embargo,
al unir las gotas con la de sulfato de cobre(II),
tal como se observa en la foto 3, 4, y 5 aumenta la producción de burbujas
, de una manera apreciable de de forma muy rápida (la secuencia de las 3 fotos
se realiza en 1 minuto), porque el Cu(II) cataliza la reacción, y las burbujas
van creciendo

Foto 3
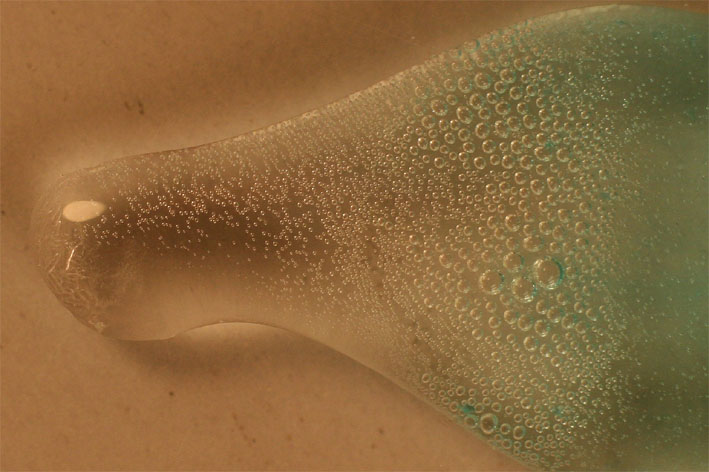
Foto 4
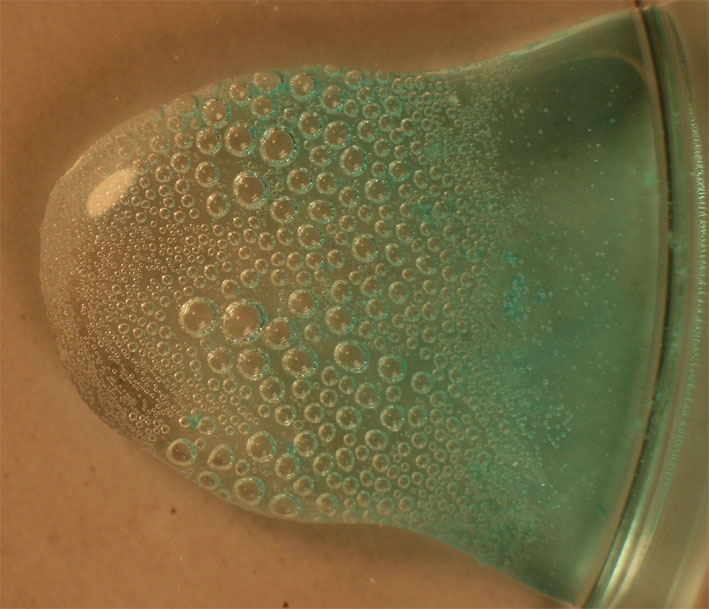
Foto 5
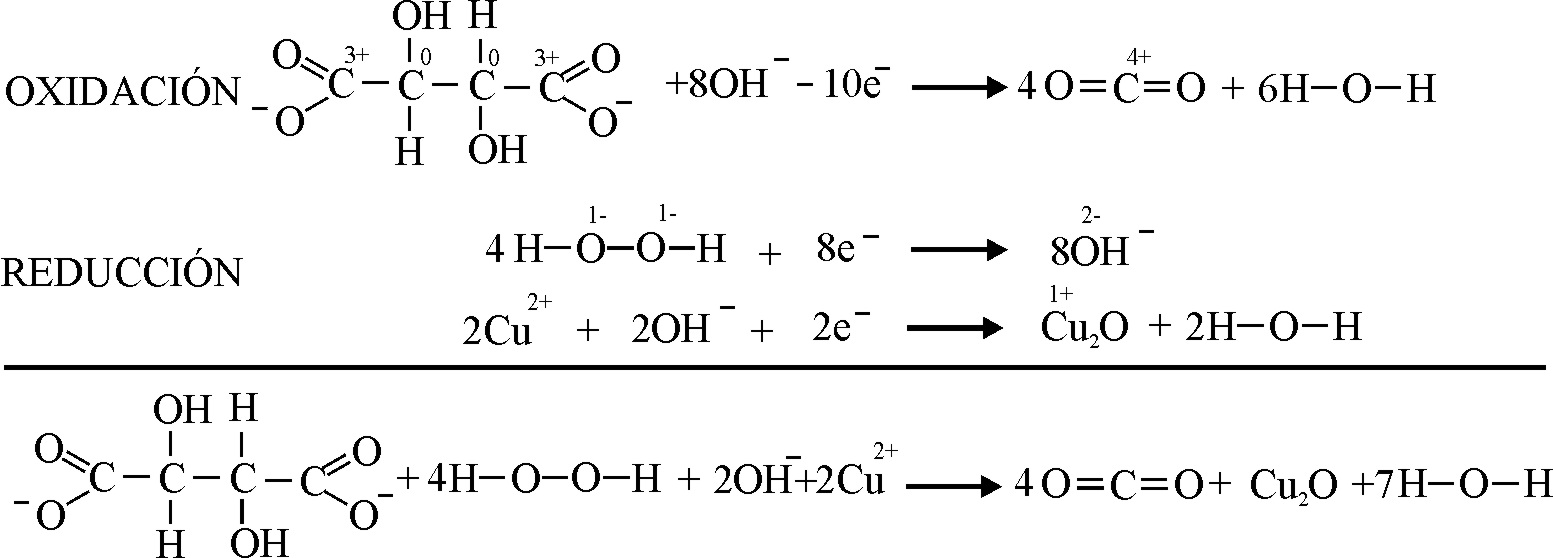
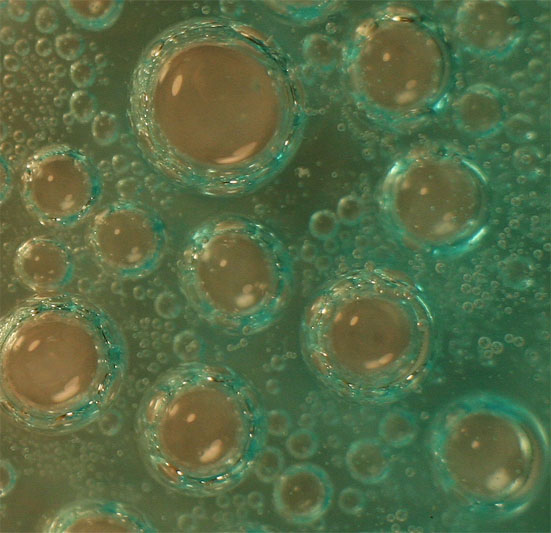
Foto 6

Foto 7

Fig.8
La producción
de oxígeno se paraliza por reacción del Cu(I) con
el peróxido de hidrógeno que trae consigo que, se oxide a Cu(II), y que aquél forme agua sin descomponerse ya que actúa como
oxidante, restaurándose el color azulado, según el proceso:
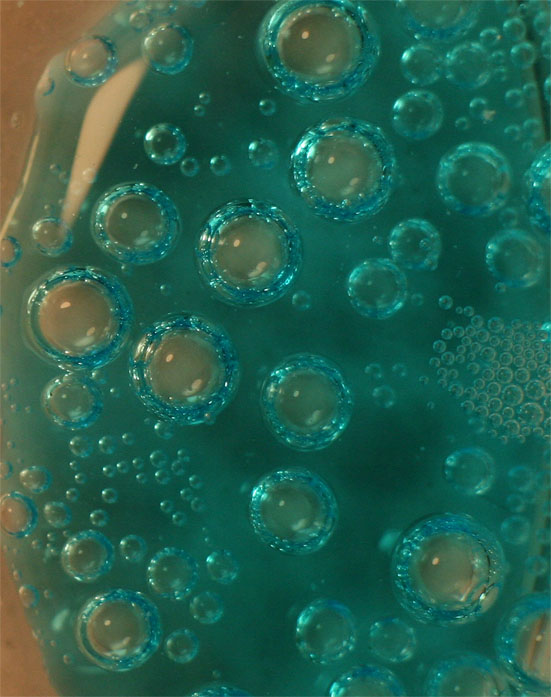
Foto 9
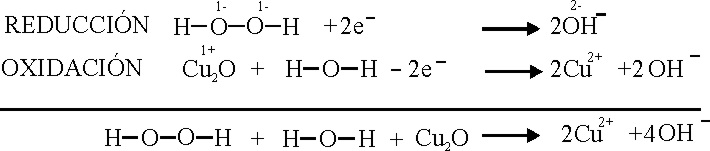

Foto 10

Foto 11