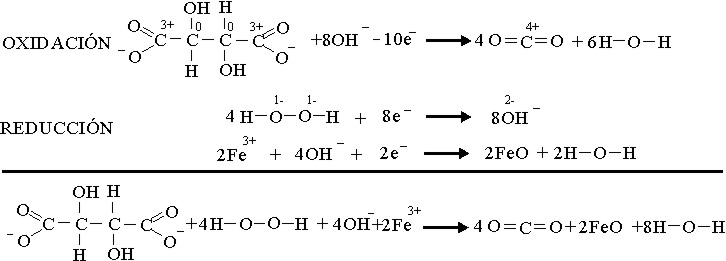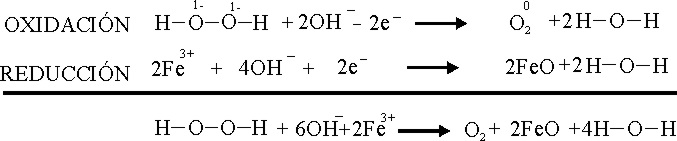ENSEÑANZA
DE LA FÍSICA Y LA QUÍMICA
sección:
QUÍMICA A LA GOTA
Descomposición
catalítica del peróxido de hidrógeno 3
Estudio de un caso particular:
Actuación redox del Fe3+
como catalizador
Aunque ya se ha estudiado
la descomposición catalítica del peróxido de hidrógeno, con iones Fe3+,
Mn4+, y Cu2+. Se van a interpretar una serie de fenómenos
secundarios que ocurren en la doble descomposición redox, del tatrato y del
peróxido de hidrógeno.
Para ello se disponen
como se costumbre, 3 gotas, en una caja petri, tal como se aprecia en la foto
1

Foto 1
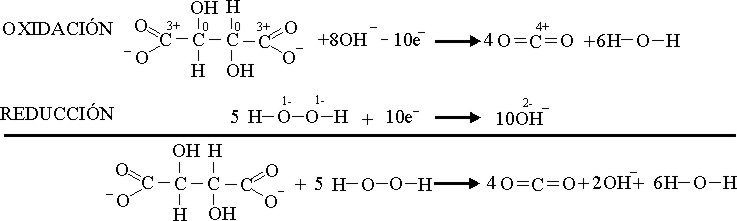
Se
unen las gotas de peróxido y tartrato en medio básico como se aprecia en la foto 2 y se observa la producción
de burbujas, debida al desprendimiento
de gases como CO2.
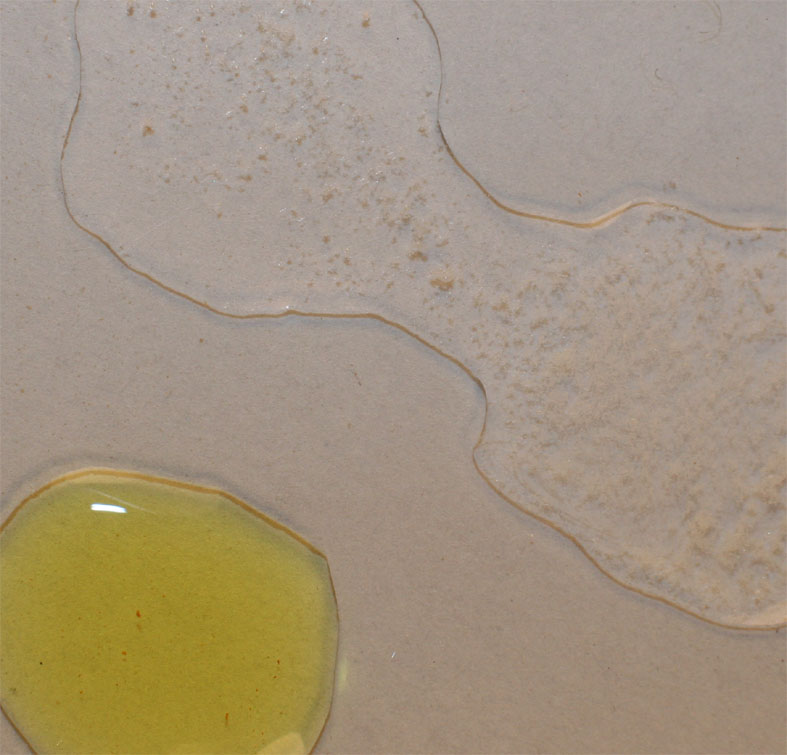
Foto 2
El
proceso redox sería:
Sin
embargo, al unir las gotas con la de cloruro férrico, tal como se observa
en la foto 3, aumenta la producción de burbujas ,
de una manera apreciable.
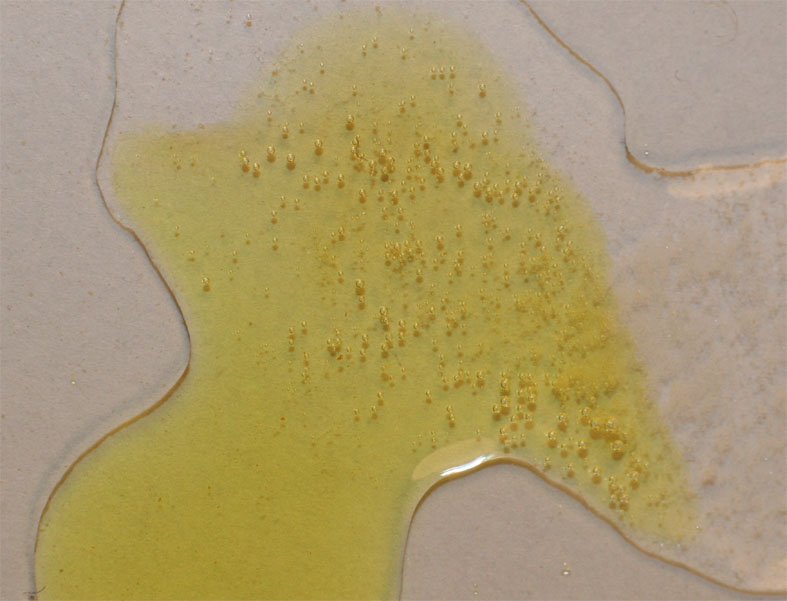
Foto 3
Pero
el Fe3+, no sólo actúa como catalizador, aumentando la velocidad
con que se producen las burbujas de gas, sino que tienen lugar un proceso
redox simultáneo en el que se reduce a óxido de hierro(II),
de color algo oscuro como se aprecia en la foto 4, (ampliación de una zona
de la caja petri, en la que se añadió unos cristalitos de cloruro
de hierro(III), formación que se justifica
así:
Pero
también y simultáneamente tiene lugar el proceso de descomposición del peróxido
de hidrógeno , con producción de oxígeno, tal como se aprecia
en las foto 5 y 6, con dos tipos de
burbujas gaseosas, las debidas al CO2 y las ocasionadas por el
O2
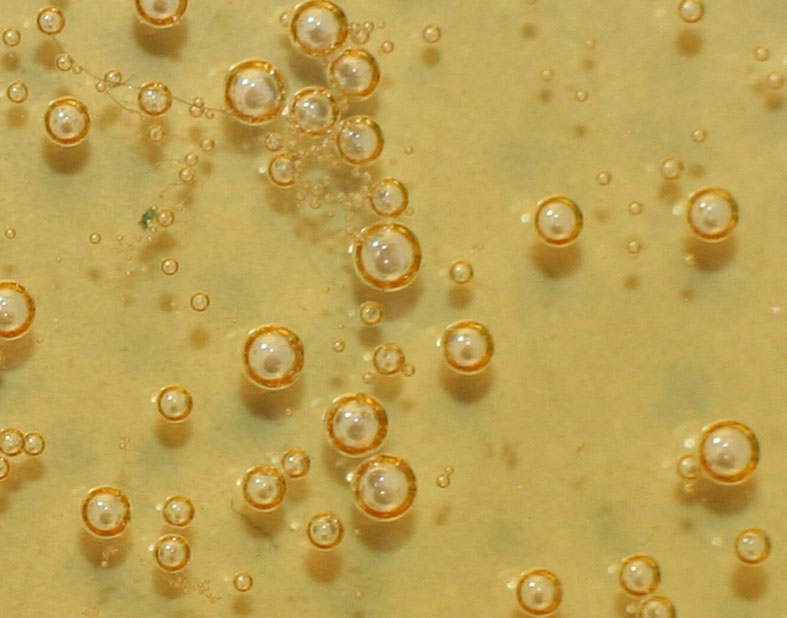
Foto 6
El
otro proceso sería :
Los
procesos redox serían similares , cuando se emplea
Cu2+ como catalizador.
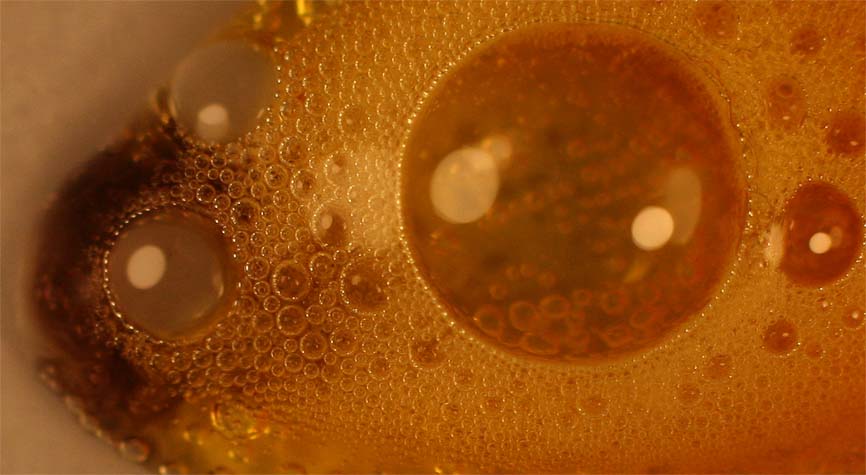
Foto 4

Foto 5
En
la zona de menor concentración de cloruro de hierro(III), el color dominante
es el amarillo (foto 6), mientras que en la de mayor, es el rojizo (foto 7)
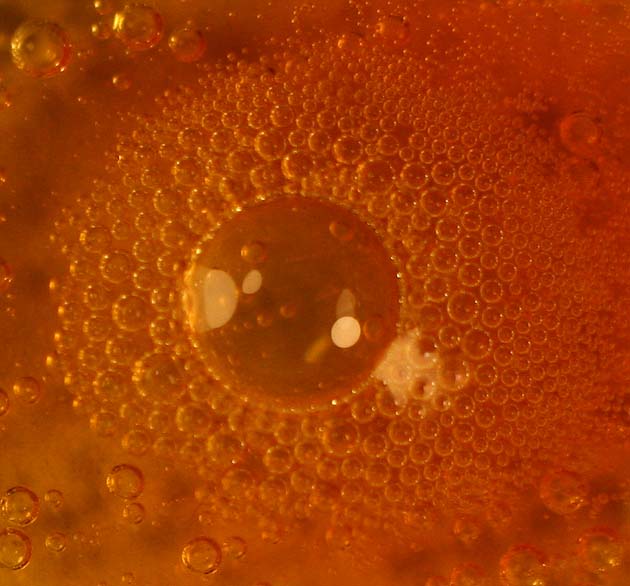
Foto 7
Al
cabo de un tiempo determinado (15 minutos), el fondo se oscure, porque todo
el hierro(III), ha pasado a Fe(II), en forma de óxido ferroso, como se
aprecia en las fotos 8 y 9

Foto 8

Foto 9