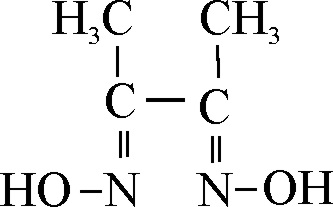
Fig.24
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
Complejos
del níquel(II) (continuación)
Se va a estudiar
ahora algún complejo del níquel(II), bidentado, esto
es con ligandos con dos puntos de coordinación. En este caso se tomará como
ligando la dimetilglioxima, y la etilendiamina, ambos con coordinación a través
de pares no ligantes del nitrógeno.
Con dimetilglioxima, se produce un complejo extraño por su estructura, muy usado en la precipitación del níquel(II). La dimetilglioxima, es un ligando bidentado que origina un campo fuerte, ya que al efecto característico de los pares no ligantes del nitrógeno, se une la acción de un doble enlace próximo y un grupo hidroxilo (fig.24), esto provoca como se explicó en la primera parte, una estructura distorsionada, por eso el complejo con la dimetilglioxima es cuadrado plano (fig1. Complejos de níquel(II)). Como la energía de desdoblamiento )1, es bastante grande, aproximadamente 20000 cm-1, el color del complejo es rojo (ver fig.3 de Complejos de níquel(II)).
La estructura del complejo, hace
que la carga del Ni(II),
se equilibre con la ionización de dos H, de los grupos OH, estabilizándose
internamente el complejo a través de dos puentes de hidrógeno O-H…O (fig.25).
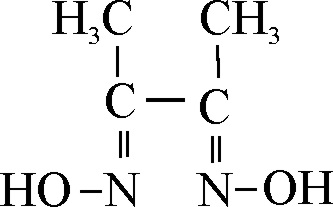
Fig.24
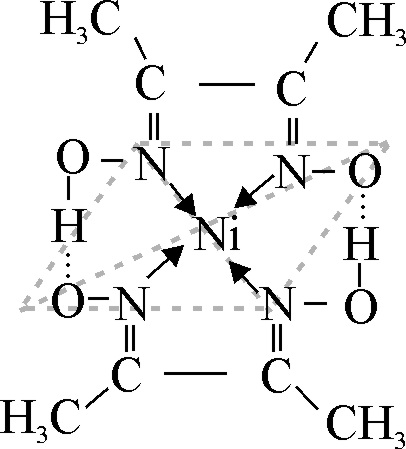
Fig.25
Primero se tomará unos cristalitos de nitrato de níquel(II) hexahidratado, que se disuelven en una gota de agua
destilada, apreciándose el color verde del complejo acuoso octaédrico ( ver
Complejos de níquel(II), en la sección correspondiente del mes anterior)
La sucesión de fotografías al
agregarle una gota de dimetilglioxima en disolución alcohólica al 1%,
es la dada, (fig.26, 27 y 28) teniendo en cuenta la depresión que se forma
al interaccionar las gotas en distinto medio.
f26.jpg)
Fig.26
f27.jpg)
Fig.27
f28.jpg)
Fig.28
f29.jpg)
Fig.29
f30.jpg)
Fig.30
f31.jpg)
Fig.31
f32.jpg)
Fig.32
f33.jpg)
Fig.33
f35.jpg)
Fig.34
f36.jpg)
Fig.35
f37.jpg)
Fig.36
f38.jpg)
Fig.37
f39.jpg)
Fig.38
Los complejos del Ni(II) con etilendiamina
H2N-CH2-CH2-NH2
son todos octaédricos. El ligando también bidentado, a través de los pares
no ligantes del nitrógeno no distorsiona lo suficiente el campo, por eso el
desdoblamiento energético es mucho menor, y se van sustituyendo los ligandos
acuo, sucesivamente por etilendiamina, por ello los cambios de color dependen
del número de ligandos sustituidos; a mayor cantidad de grupos nitrógeno,
mayor desdoblamiento ( desde 16000 cm-1 hasta los 19000 cm-1),
y el color pasa de azul verdoso, a azulado y por fín púrpura en el caso de
la sustitución completa (fig.39, 40 y 41).
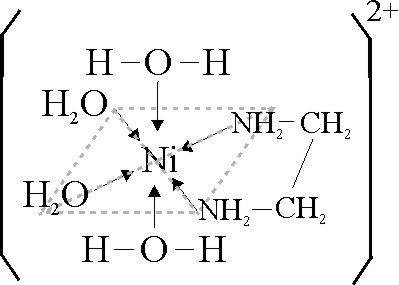
Fig.39
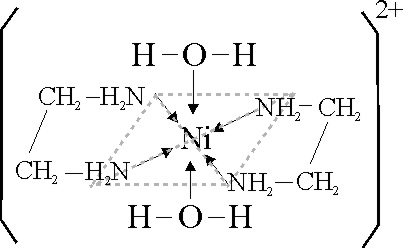
Fig.40
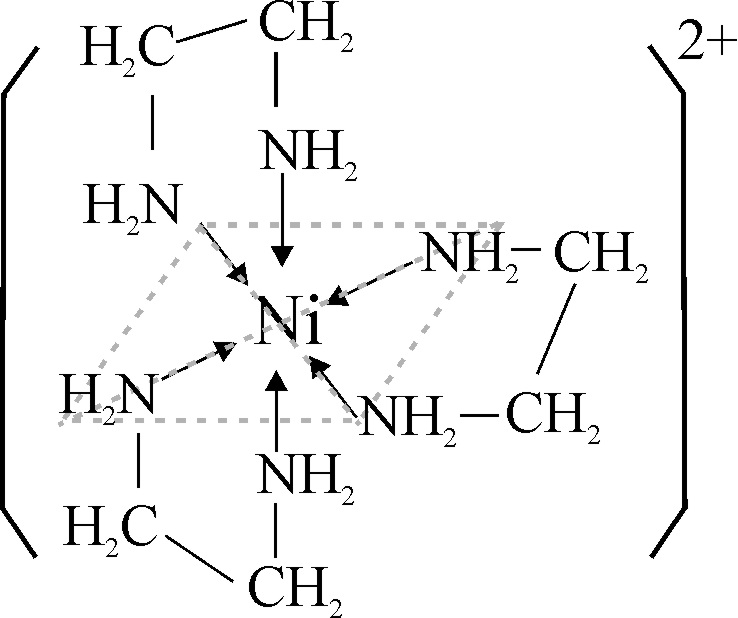 Fig.41
Fig.41
f43.jpg)
Fig.42
f44.jpg)
Fig.43
f45.jpg)
Fig.44
f46.jpg)
Fig.45
f47.jpg)
Fg.46
f48.jpg)
Fig.48
f49.jpg)
Fig.47