Fig.1
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
Complejos
del níquel(II)
El níquel (II), presenta complejos
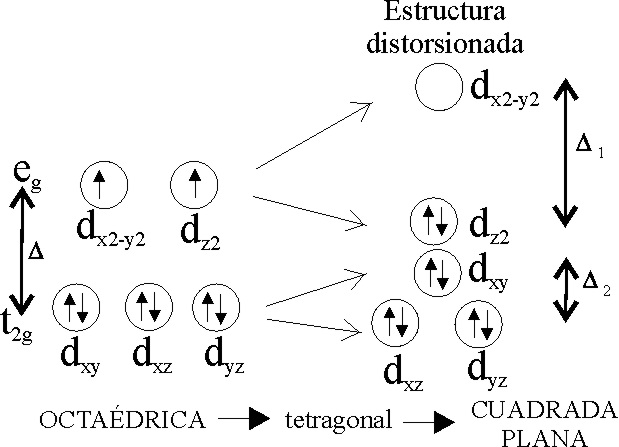
octaédricos, tetraédricos y cuadrados, se forma similar al Cu(II). Esto se debe a que tiene una estructura atómica 3d8,
disponiendo esos 8 electrones en dos niveles (t2g)6
(eg)2, que debido a las distorsiones se desdoblan a
su vez según la fig.1. Forma complejos paramagnéticos, con dos electrones
desapareados, por ello sus momentos magnéticos oscilan entre los 2,9 y 3,4
magnetones Bohr (excepcionalmente existe un complejo octaédrico diamagnético,
posiblemente por que parte de una estructura electrónica diferente).

Fig.1
Se va a partir en nuestra parte experimental ya del sulfato de níquel(II) heptahidratado [1] , ya del nitrato de niquel (II) hexahidratado, disolviéndolo en una gota de agua destilada. La estructura del acuocomplejo, vendría dada en la fig.2.
El hexaacuocomplejo octaédrico, absorbe energía a 25000cm-1, 14000 cm-1 y 9000cm-1, el color que surge se debe a la segunda banda de absorción (véase fig 3, explicada en el trabajo “Complejos del Co” en esta misma sección).
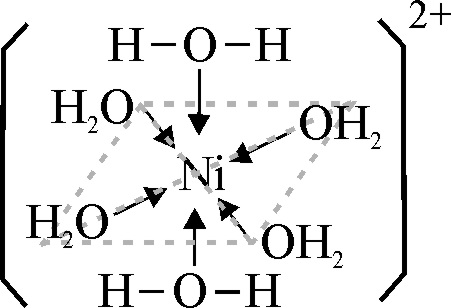
Fig.2

Fig.3
El acuocomplejo presenta un color
verdoso (fig 4)
Como siempre las fotografías de
las reacciones e intercambio de ligandos se toman de forma que la superficie
de las gotas presentadas sea como máximo
de1-2 cm2.
Se disuelven unos cristalitos
de nitrato de níquel(II) hexahidratado en una gota
de agua (fig4), y se le hace interaccionar con una gota de hidróxido amónico
concentrado, la sucesión de figuras 4,5 6 y 7, marca su desarrollo.

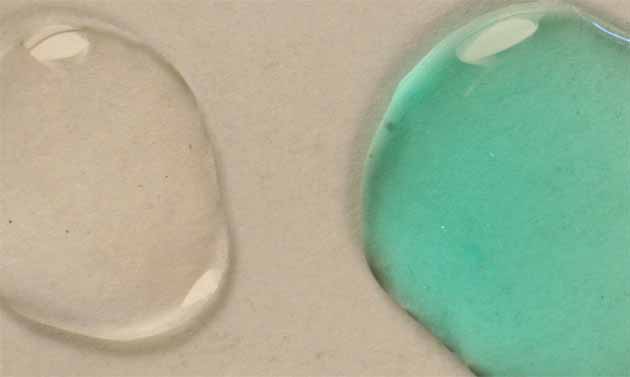
Fig.5
Fig.6
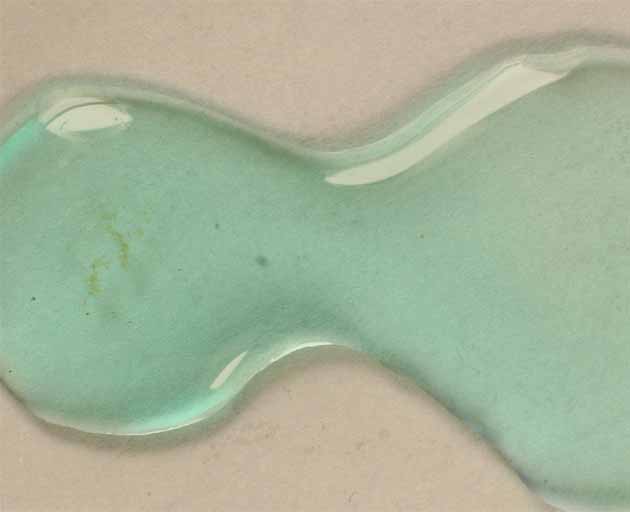
Fig.7
Al aumentar el desdoble energético, se produce un ligero corrimiento hacia al azul, característico de los hexaammin complejos del Ni(II).
La estructura del complejo es la dada en la figura 8.
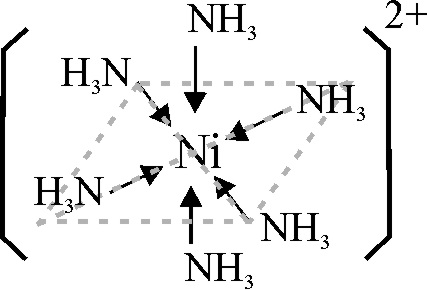
Fig.8
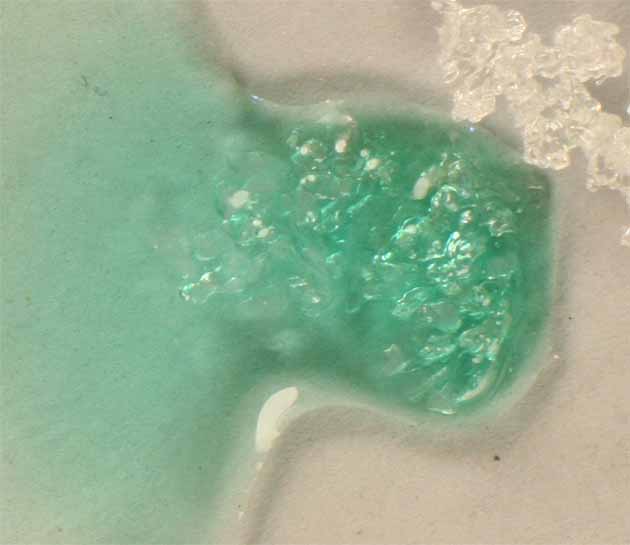
Fig.9

Fig.10
Si lo hace, en cambio la reacción tanto con ferrocianuro potásico K4(Fe(CN)6 como con ferricianuro potásico K3(Fe(CN)6 como veremos.
Con el primero se produce la sucesión de fotos expuestas en las figuras 11,12, 13, 14, 15 y 16.
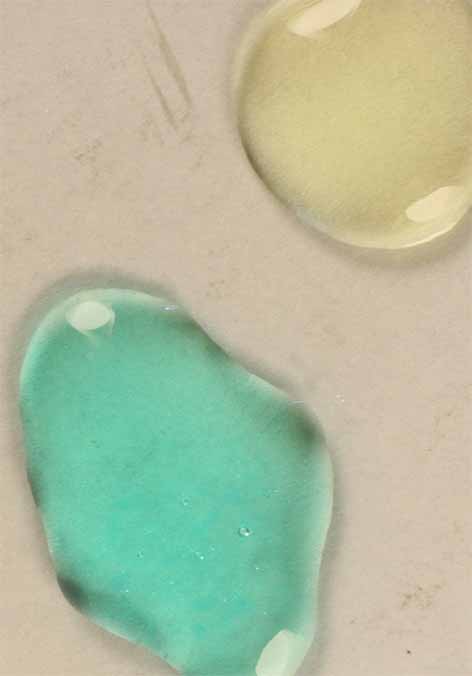
Fig.11
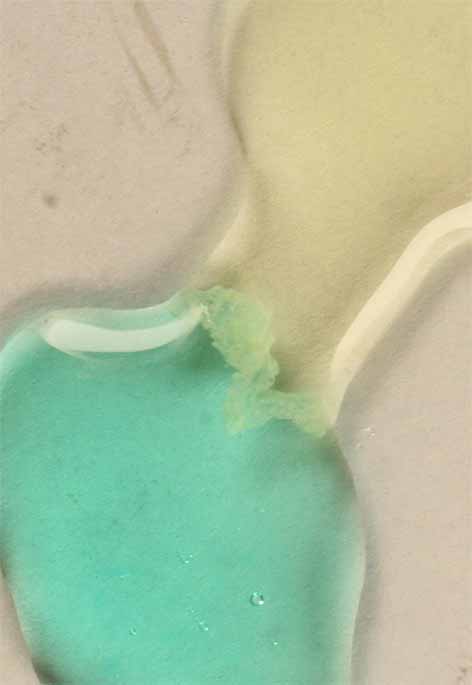
Fig.12
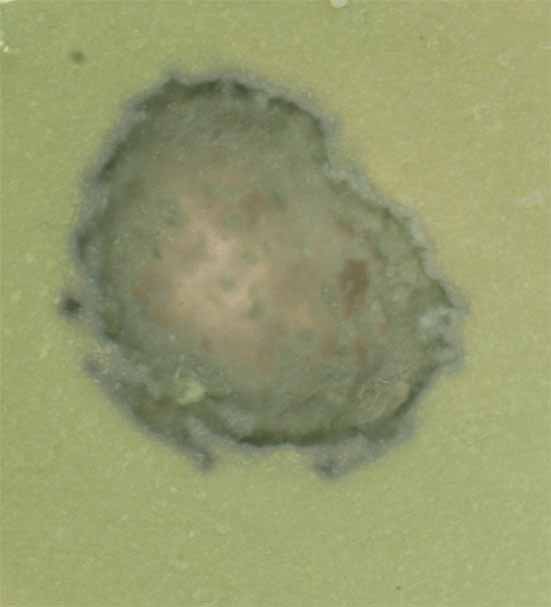
Fig.16
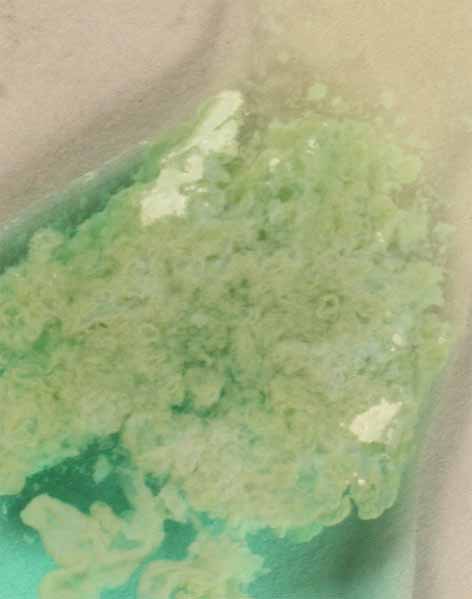
Fig.13

Fig.14

Fig.15
En esta situación, se añade una gota de NaOH 6N, en el centro de la caja Petri (fig
16)
Con ferricianuro potásico se aprecia mejor la formación del
ciano complejo de níquel(II) amarillo

Fig.17
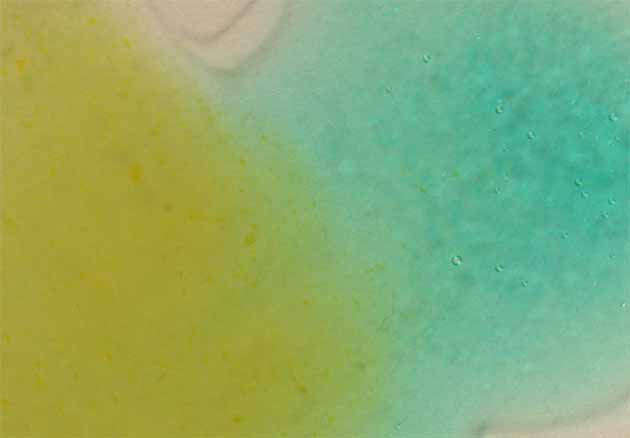
Fig.18
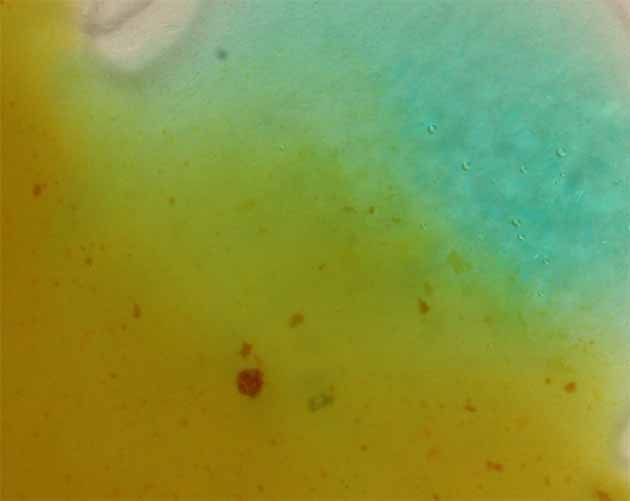
Fig.19
Fig.20

Fig.22

Fig.21
Los complejos cianurados, debido a que el ligando ciano, produce una fuerte interacción (ligando de campo fuerte en la serie espectroquímica de Tschusida), provoca tal distorsión, que el octaedro se deforma hasta una estructura cuadrada plana, tal como se aprecia en la fig 1, dando lugar, debido a su mayor capacidad de absorción energética, un color amarillento.
La estructura del tetraciano complejo de níquel(II), sería, la dada en la fig.23
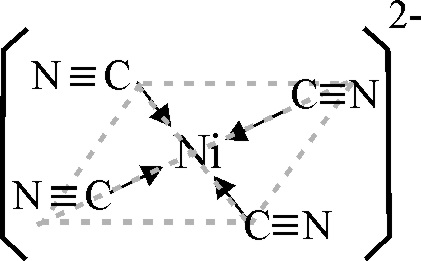
Fig.23
[1] Este compuesto presenta una coordinación al ion Ni(II), con 6 moléculas de agua. La séptima molécula, está ligada al ion sulfato por puente de hidrógeno tal como ocurría en el caso del sulfato de cobre(II) pentahidratado ( véase el trabajo “Complejos del cobre” en esta misma sección.