Fig.1
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
Complejos
del cromo(III)
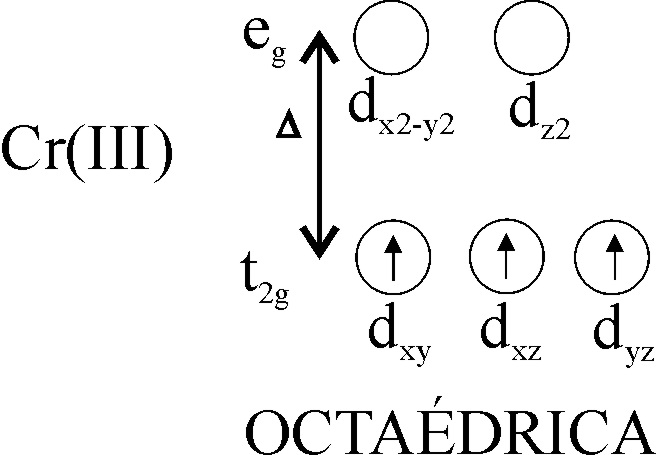
El ion Cr(III) tiene una estructura
atómica 3d3, disponiendo esos 3 electrones en el nivel (t2g)3
y dejando vacío el (eg)0,
por lo que es paramagnético, pero suficientemente estable (fig.1).

Fig.1
Los complejos son siempre octaédricos y su color se debe al mayor o menor valor de ). Este valor sólo depende del campo creado por los ligandos, siguiendo la serie espectroquímica de Tschusida. Los complejos son muy estables y su intercambio difícil (especialmente si no se calienta).
Se va a partir en nuestra parte
experimental, del sulfato de cromo
(III) cristalizado, disolviéndolo en una gota de agua destilada. La estructura
del acuocomplejo, vendría dada en la fig.2. Presenta bandas de absorción a
17400cm-1, 24700cm-1 y 37000cm-1. La primera
es la responsable del color violeta que presenta tanto en estado sólido como
en disolución acuosa (fig 3 y 4).
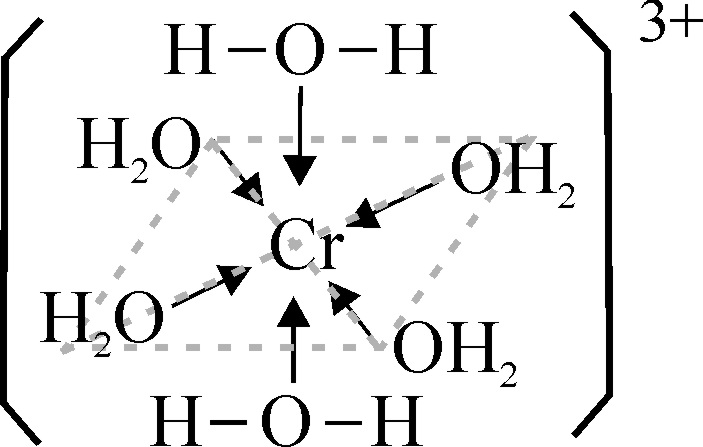
Fig.2

Fig.3
Fig.4
Como siempre las fotografías de las reacciones de intercambio de ligandos se toman de forma que la superficie de las gotas presentadas sea como máximo de1-2 cm2.
Primero se trata con una gota
de HCl 1M, y poco cambio se observa. Tiene que emplearse HCl 35%. La sustitución
de ligandos acuo por ligandos cloro,
de campo menos intenso, provoca que la energía absorbida sea menor con lo
cual el color toma verde marrón . En
las fotos se deja como muestra, el producto sólido y disuelto en agua, a fin
de apreciar mejor los cambios de color. (fig. 5-8).
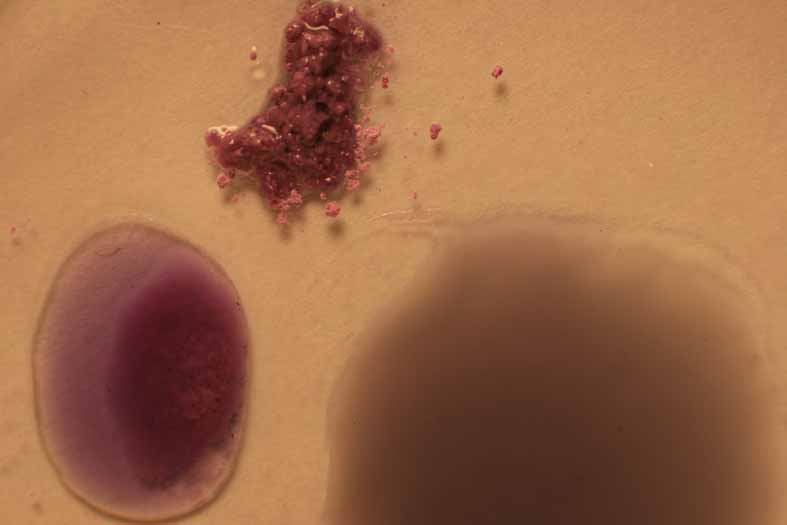
Fig.5
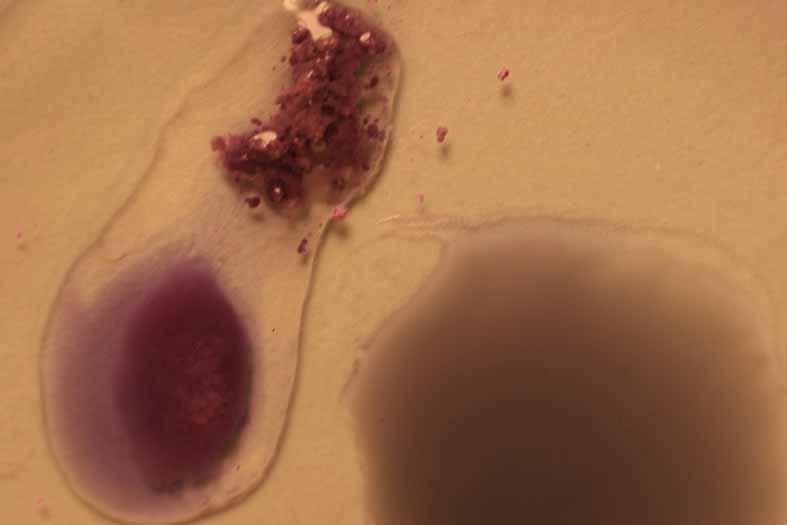
Fig.6
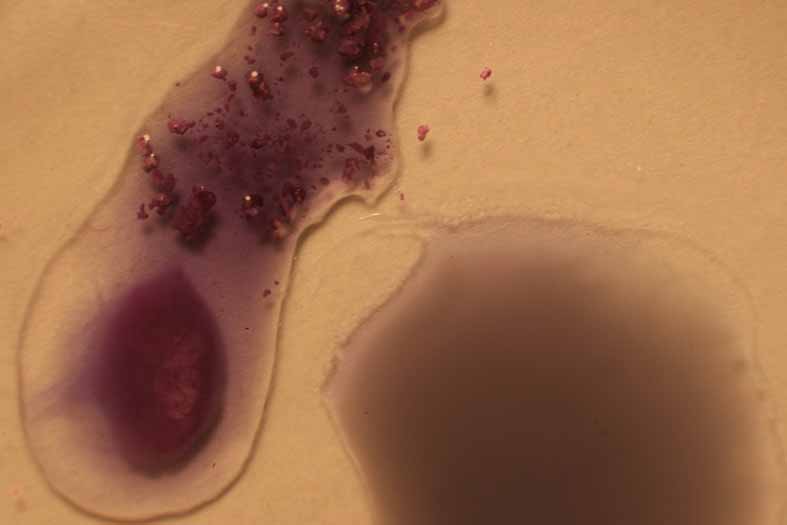
Fig.7
Fig.8
La figura 8 se obtiene por cristalización
del estado final y en ella se observan
mejor los colores definitivos.
La estructura de los complejos
formados por sustitución sucesiva de ligandos acuo por cloro viene en las
fig 9 y 10.
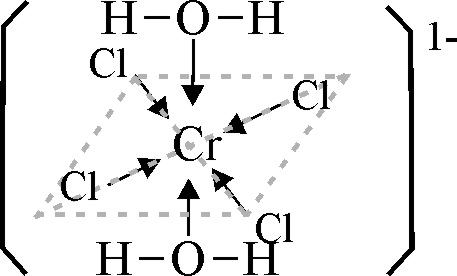
Fig.9
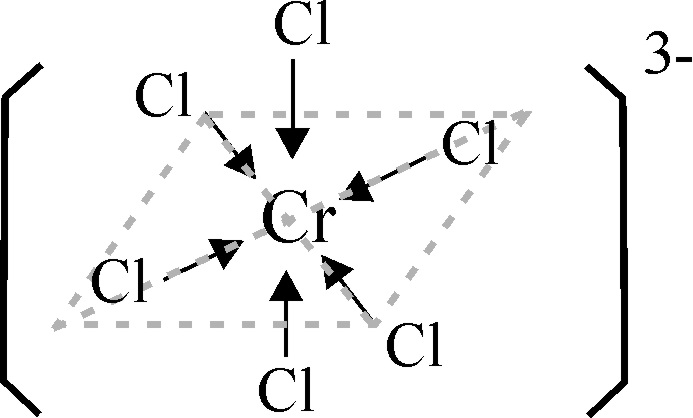
Fig.10
Fig.11
Fig.12
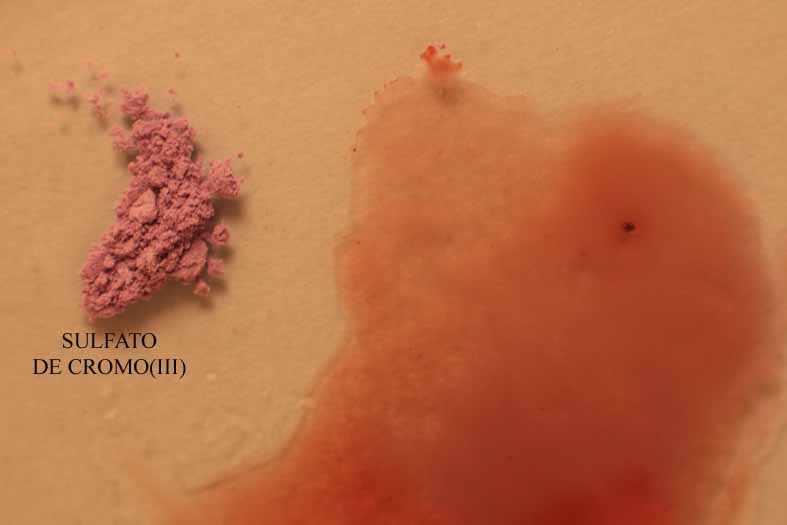
Fig.13
Fig.14
Fig.15
En la fig 13, se vuelve a introducir unos cristalitos de sulfato de cromo (III), para que se aprecie mejor el contraste de color.
El color rojo intenso que aparece en la fig 14, posiblemente indique la formación de un complejo binuclear, tal como ocurría en el tema anterior en los complejos de cobre(II).
En la fig 15, se muestra una foto ampliada tomada horas después.cuando se produce la cristalización de los productos.
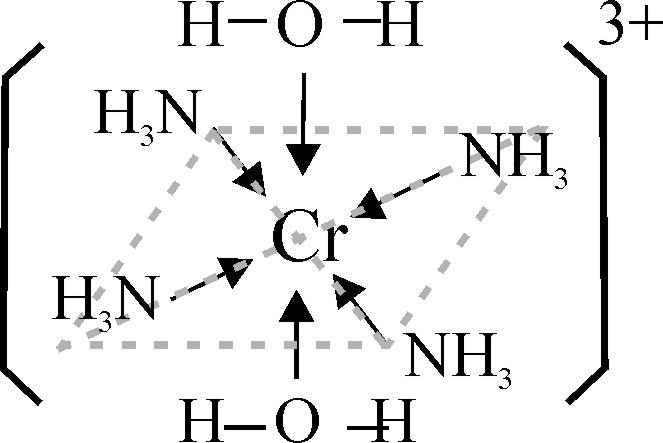
Fig.16
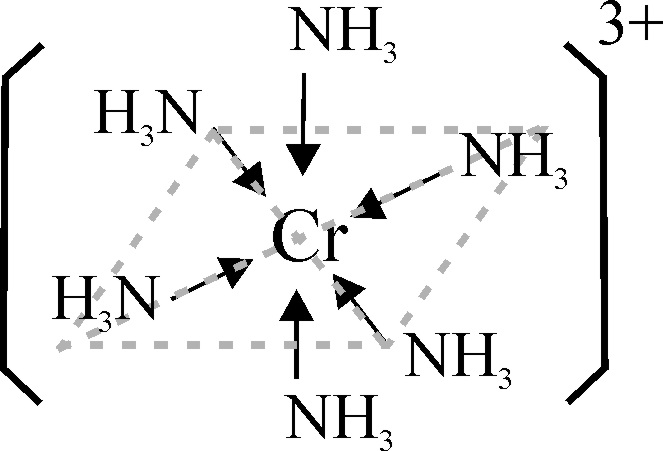
Fig.17
Las figuras 18 y 19 de las fotos
tomadas, muestran que no existe una sustitución total de ligandos, dado que
el mayor desdoblamiento del campo produciría una mayor absorción de energía (por encima de 22000 cm-1), debiendo
aparecer si esto ocurriera, un color amarillo cuando lo que se aprecia
es una mezcla de verde, morado y castaño.
Fig.18
Fig.19
El tratamiento con ferricianuro potásico, permite sustituciones
con el grupo ciano, que también produce un mayor desdoblamiento. Las figuras
20 a 25, corresponden a la sucesión de fotografías
tomadas, a partir de los productos sólidos
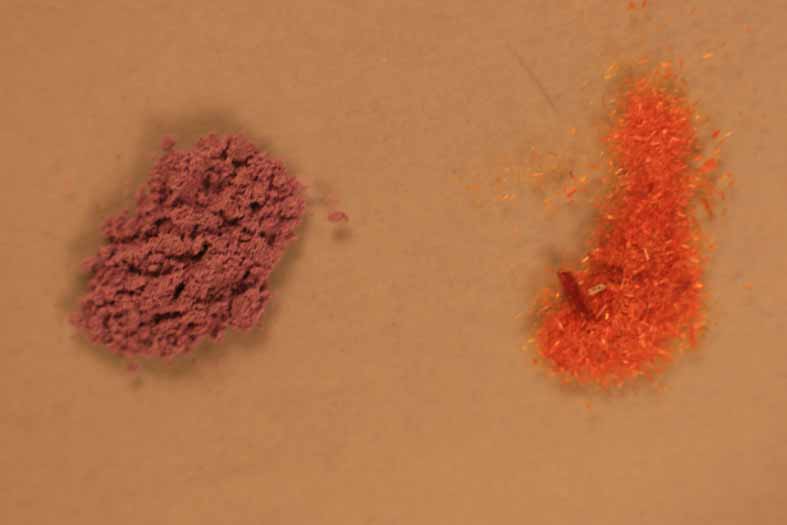
Fig.20
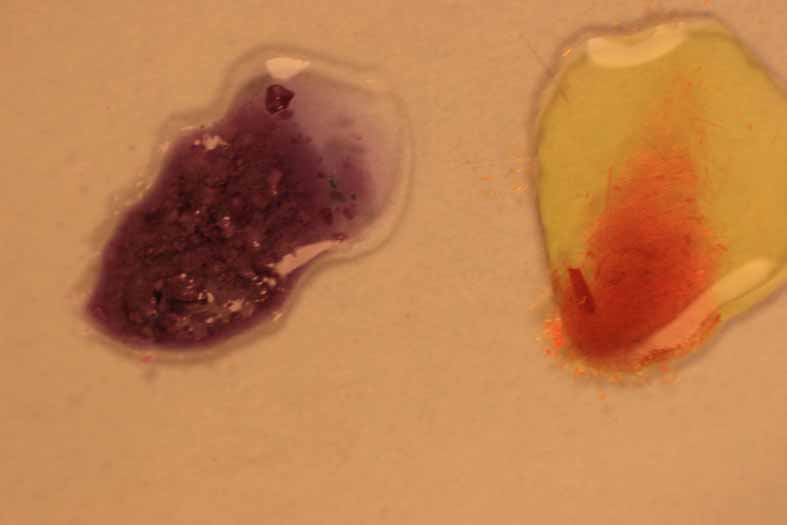
Fig.21
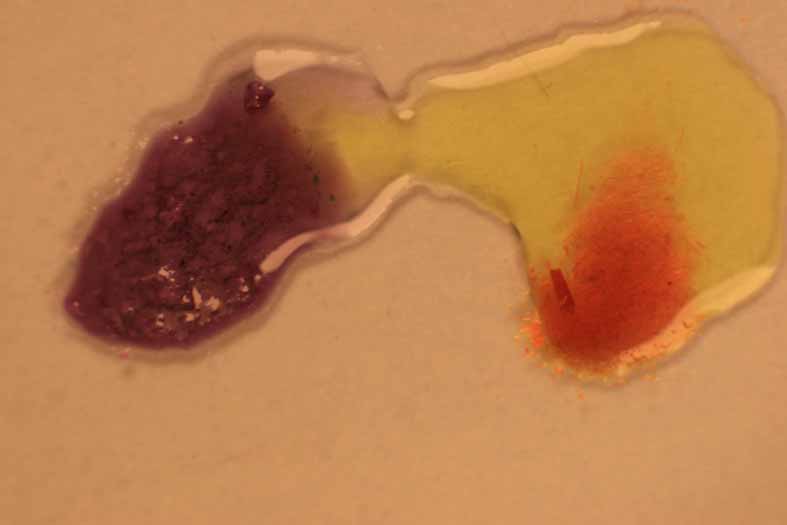
Fig.22
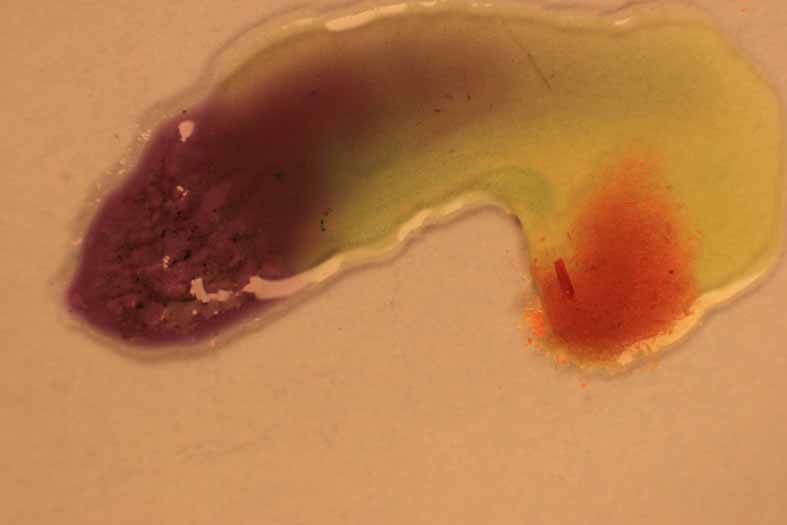
Fig.23
Fig.24
Fig.25