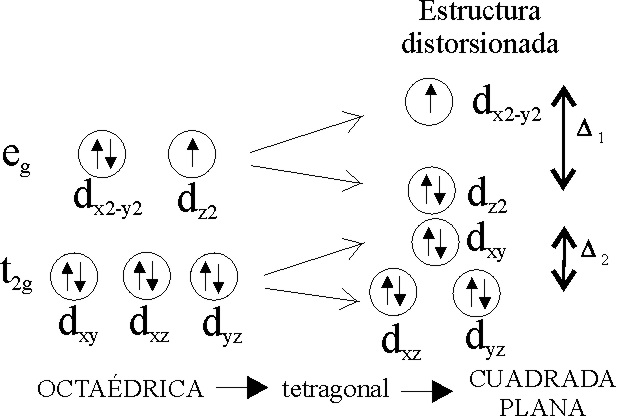
Fig.1
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
Complejos del cobre(II)
El sulfato de cobre(II),
que fue motivo de una práctica de Química, en su día (“Determinación de los
moles de agua de cristalización de una sal cristalizada, aplicación al CuSO4.5H2O”),
tiene una estructura compleja, en la cual cada ión Cu(II), se coordina con
4 moléculas de agua, mientras la quinta molécula de agua, se une al sulfato
por puentes de hidrógeno. O sea que los
compuestos de cobre(II) que habitualmente usamos
forman estructuras habituales complejas, aunque no las consideremos, y estas
estructuras son las responsables de
los espectaculares colores que presentan.
Sin embargo, no es fácil explicar la estructura de estos complejos. En principio se podría pensar en una coordinación octaédrica, generalmente con cuatro ligandos. Cuando se dispone de seis, cuatro están casi en un mismo plano, mientras que los otros dos aparecen en el eje axial a mayor distancia. También se podría considerar como una coordinación tetraédrica pero con un tetraedro muy distorsionado, tanto que los cuatro ligandos estaría en el mismo plano. La distorsión se debe a dos efectos contrapuestos, el Janh-Teller y un acoplamiento spin-órbita.

Fig.1
El color se debe al mayor o menor
valor de )1.
Este valor depende de la distorsión, que a su vez no sólo se ve afectada como
en complejos anteriormente estudiados,
por la interacción eléctrica que provocan los ligandos con sus pares electrónicos,
siguiendo la serie espectroquímica de Tschusida, sino también por efectos
estéricos al acomodar dichos ligandos en el tetraedro distorsionado.Estos
hechos hacen que la posibilidad de
cambios de colores por intercambio de ligandos sea muy fácil.
Se va a partir en nuestra parte experimental del cloruro de cobre(II) dihidratado, disolviéndolo en una gota de agua destilada. La estructura del acuocomplejo, vendría dada en la fig.2.
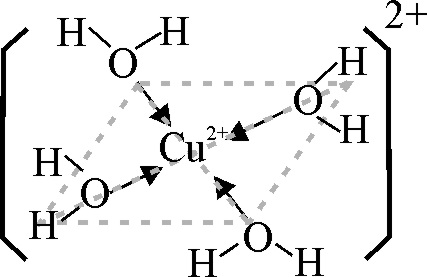
Fig.2

Fig.3

Fig.4
Como siempre las fotografías de las reacciones e intercambio de ligandos se toman de forma que la superficie de las gotas presentadas sea como máximo de1-2 cm2.
Se trata con una gota de HCl 1M.
La sustitución de ligandos acuo por ligandos
cloro, de campo menos intenso, provoca que la energía absorbida sea
menor con lo cual el color toma tonos amarillentos (fig. 5-7).
Fig.5

Fig.6
Fig.7
Sin embargo, este color se va tornando verdoso por combinación entre el azul y el amarillo (fig.7).
La estructura del complejo formado viene
en la fig 8
El tratamiento con NaBr(s), que se disuelve en el complejo, provoca la sustitución de ligandos Cl por Br, con un espectacular cambio de color (fig. 9, 10, 11), más debido al efecto estérico por la acomodación del ligando bromo mas voluminoso que el cloro, que a la intensidad del campo eléctrico de este último ligando.
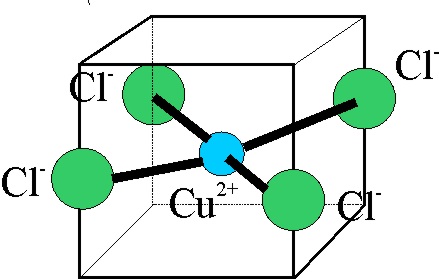
Fig.8
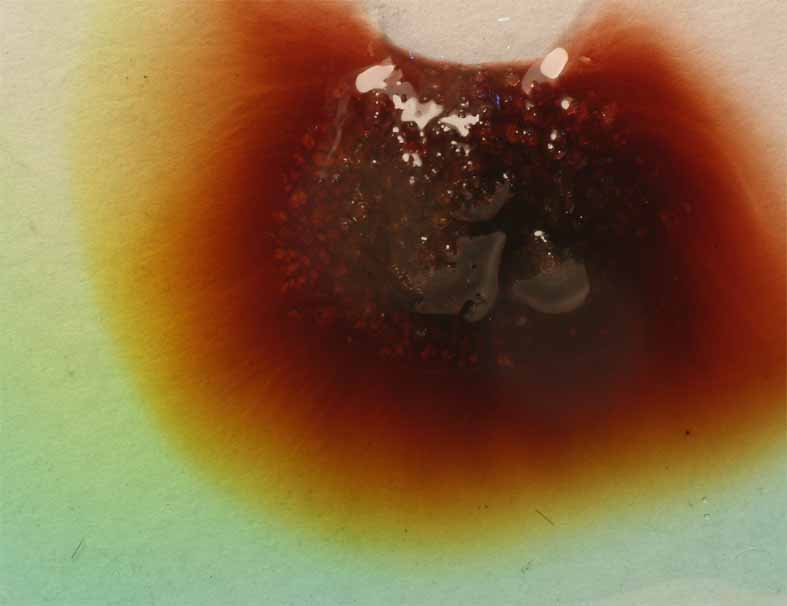
Fig.9
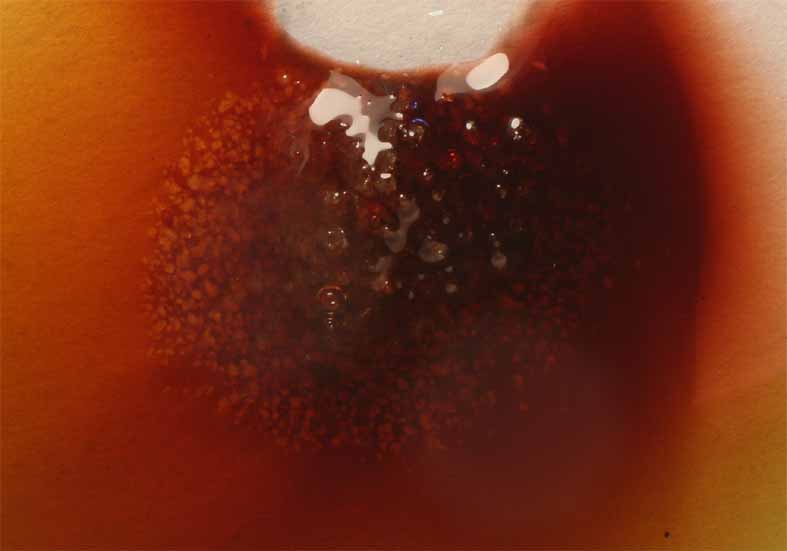
Fig.10
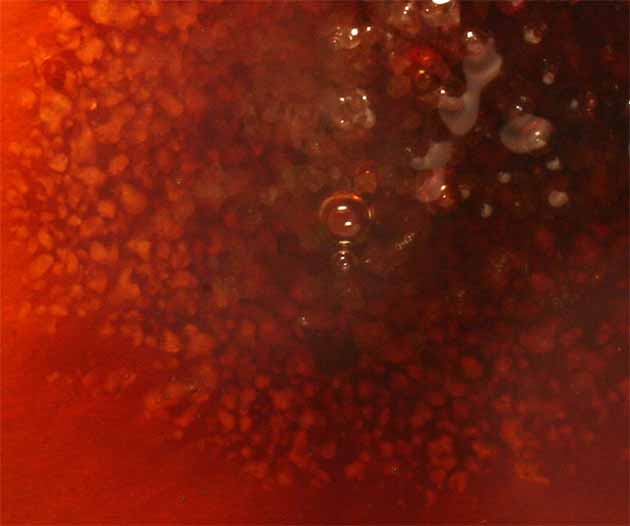
Fig.11

Fig.12
La estructura del complejo con
el tetraedro distorsionado (fig.13), produce una coloración marrón oscura
con tendencia al rojo. En este caso
(fig.11), se forma un complejo de doble núcleo con dos Cu, y 6 Br-
Cuando se diluye (fig 12), echando
unas gotas de agua destilada, el complejo se destruye, desapareciendo el color
intenso.
Si ahora se agrega CuCl2.2H2O(s), en principio, al disolverse, aparece una coloración verde fuerte, por combinación del amarillo del complejo clorado con el azul propio del compuesto (fig.14), pero despues se agrega HCl concentrado(35%) volviéndose a la tonalidad rojiza del complejo de doble núcleo , esta vez de fórmula (Cu2Cl6)2-(fig.16).
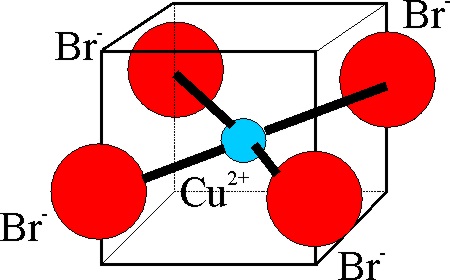
Fig.13
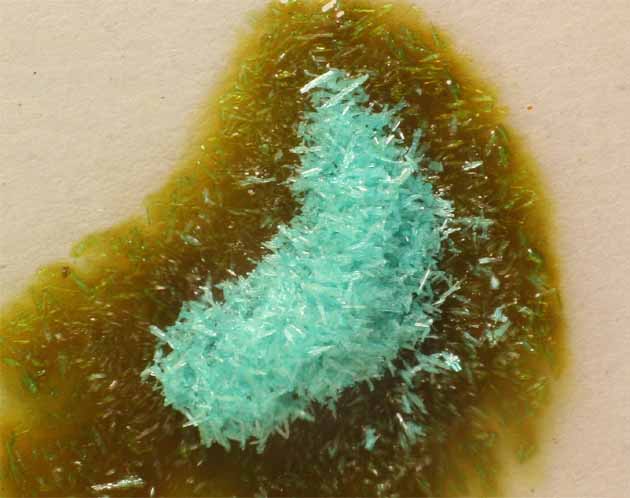
Fig.14
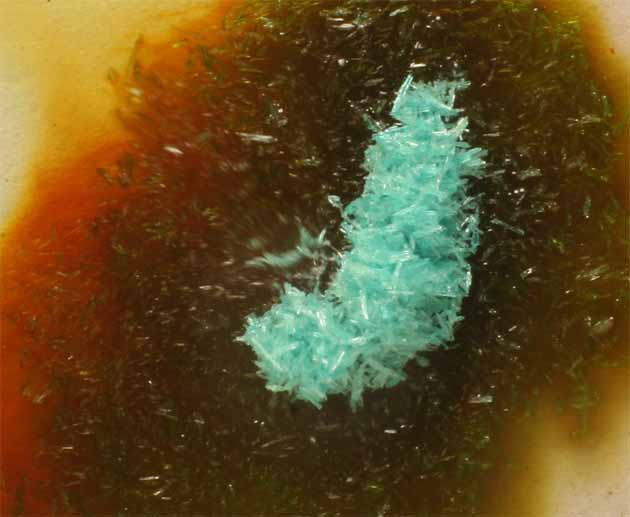
Fig.15
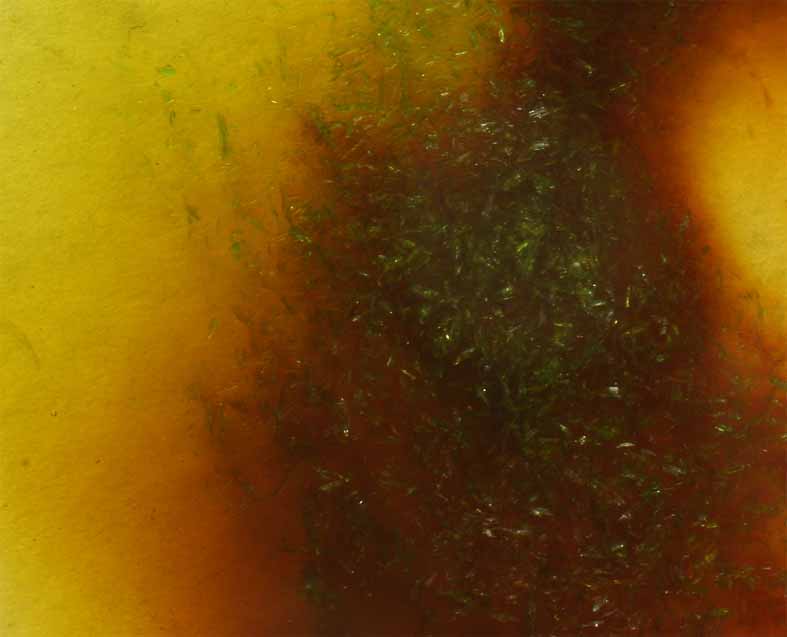
Fig.16

Fig.17
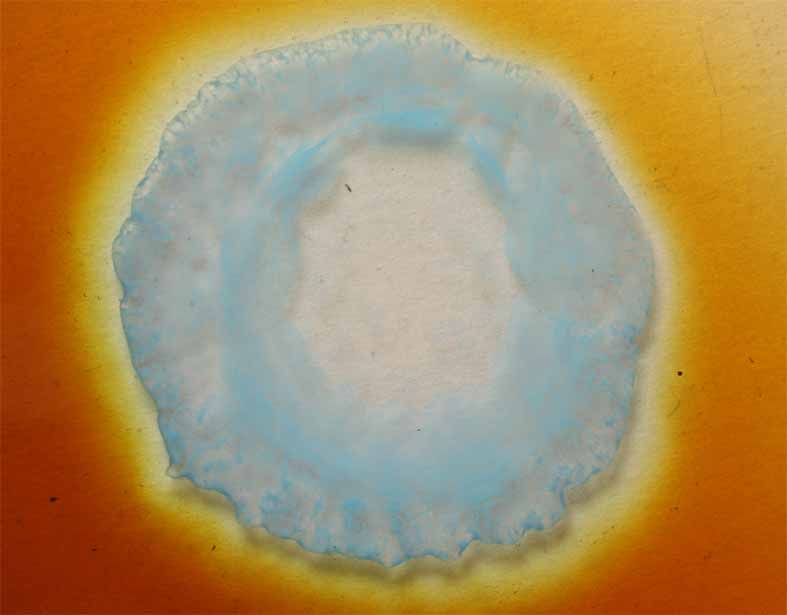
Fig.18

Fig.19

Fig.20

Fig.21
Hasta ahora se ha trabajado con ligandos de campo débil. Vamos ahora a iniciar una serie de sustituciones con otros ligandos. Para ello se trata el cloruro de cobre(II) dihidratado y disuelto en agua (fig 23), con oxalato sódico (s).
La formación de un complejo bidentado (quelato), va introduciendo un color azul más intenso (fig.24 y 25), que se refuerza al intercambiar los ligandos con el NH3, previo tratamiento con gotas de hidróxido amónico (fig.26). La estructura del complejo, viene en la fig.22
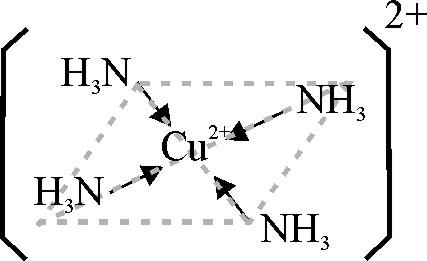
Fig.22
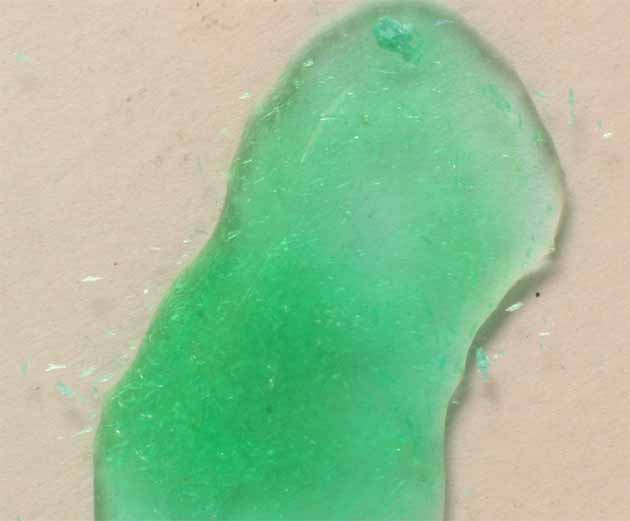
Fig.23

Fig.24

Fig.25
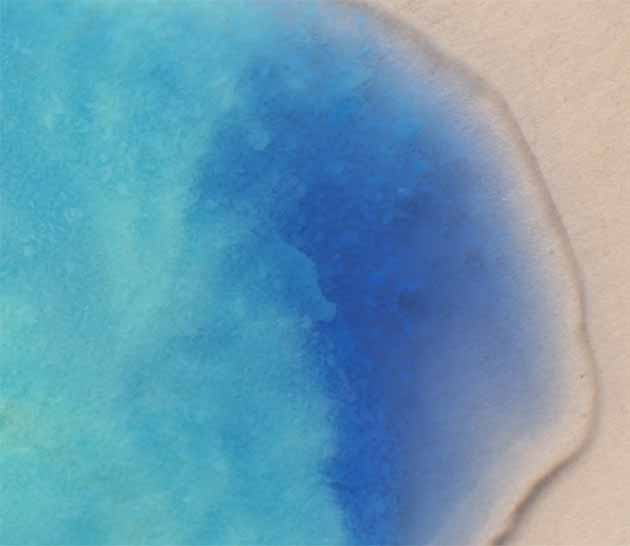
Fig.26

Fig.27

Fig.28

Fig.29

Fig.30

Fig.31

Fig.32
El efecto Janh-Teller, enunciado
en 1937 implica una mayor repulsión
de los ligandos en coordinación octaédrica sobre el eje z, que tiende a alejarlos,
hasta tal punto que esos dos ligandos, en algunos casos se pierden, por ello
es difícil encontrar complejos hexacoordinados del Cu(II).
El ion Cu(II) tiene una estructura atómica 3d9, disponiendo esos 9 electrones en dos niveles (t2g)6 (eg)3, que debido a las distorsiones se desdoblan a su vez según la fig.1.