ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
Complejos del Co (continuación)
Los compuestos de coordinación
del cobalto(III) , que fueron los primeros estudiados,
son difíciles de obtener, puesto que
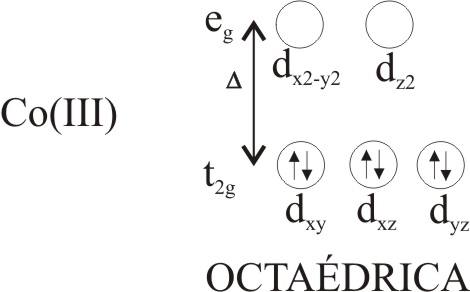
son menos estables que los de Co(II) vistos con anterioridad. El Co(III) dispone de 6electrones en los orbitales 3d,
ello hace que el desdoblamiento de
esos orbitales en función de la interacción con los ligandos, grupos con pares
de electrones solitarios, permita saltos electrónicos por absorción de energía
luminosa en el espectro visible, que provoca que el compuesto tome colores complementarios espectaculares,
muy apropiados para ser visionados en foto
digital.
Sin embargo a diferencia de los de Co(II), todos tienen simetría octaédrica (sólo se conoce un
complejo tetraédico), y excepto con el ligando F-, son de bajo
espín lo que indica que todos los electrones están apareados, según el esquema:

Las fotografías que se presentando, abarcan una superficie entre
1-2 cm2 .
Se toman unos cristalitos
de Co(NO3)2 ( fig.1),
a los que se agrega H2O2,
para oxidar el Co(II) a Co(III), junto con dos gotas una de HCl concentrado y otra de HN4OH
concentrado ( fig.2). Se mezclan las gotas
y se observa la formación de un
compuesto marrón, otro rojizo (fig.5), y al echar una gota de hidróxido amónico
sobre el sistema se aprecia el círculo verde ( fig.6)

Fig.1
Fig.2
Fig.3
Fig.4
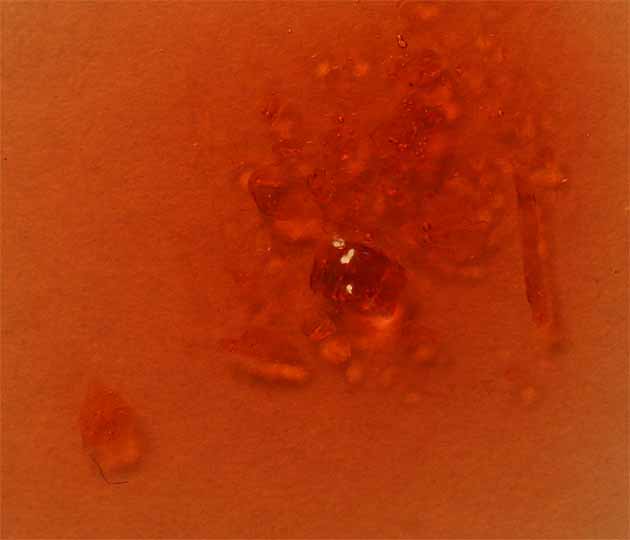
Fig.5
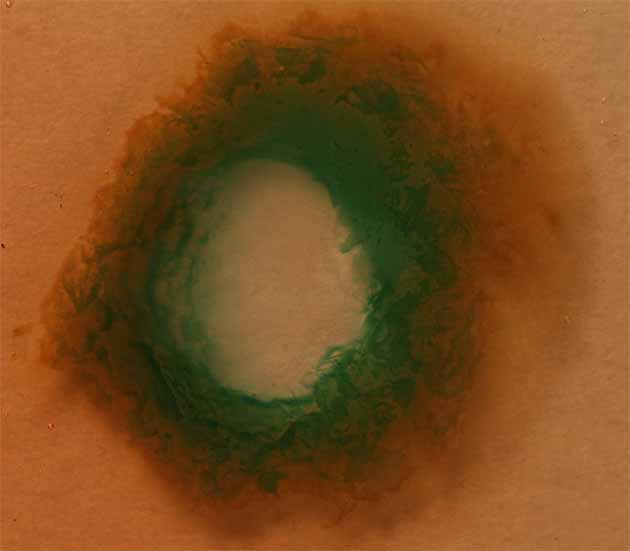
Fig.6
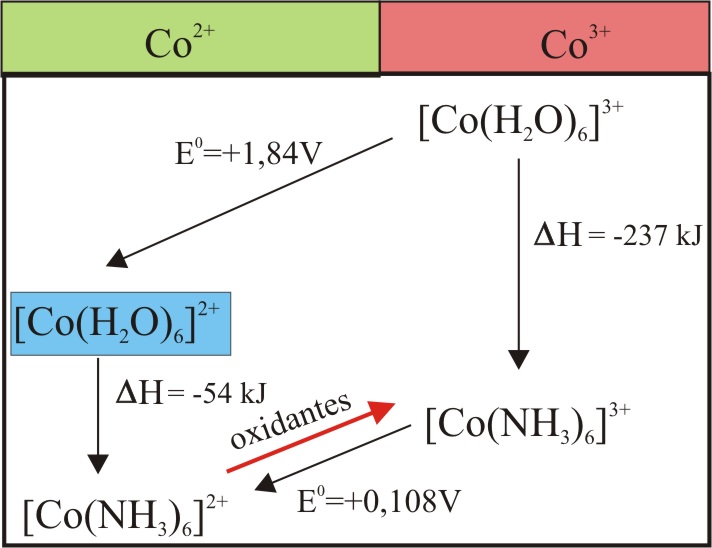
Tabla 2
Fig.7
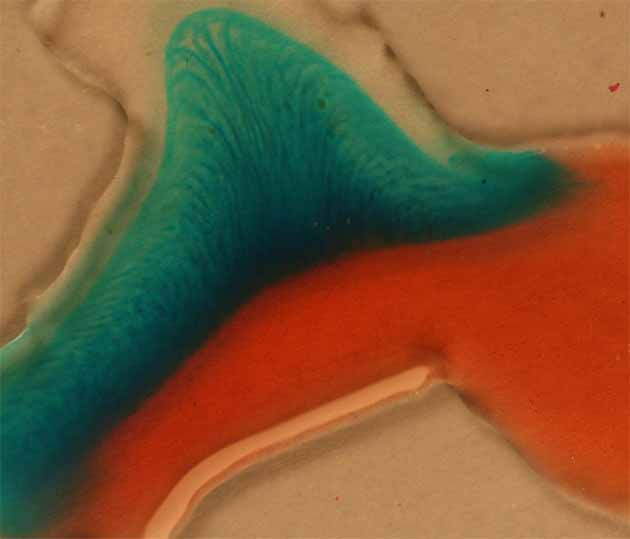
Fig.8
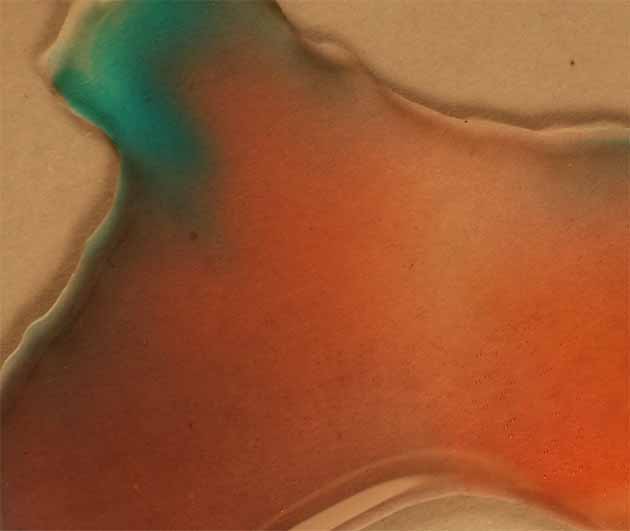
Fig.9
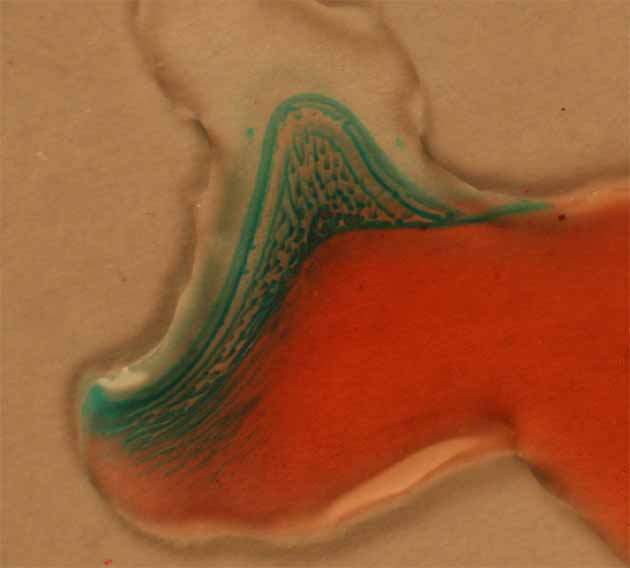
Fig.10
Se repite con CoCl2 hexahidratado(s), disuelto en amoniaco diluido, para iniciar la oxidación desde un compuesto más fácil de oxidar con agua oxigenada, según la tabla 2. El compuesto formado verdoso azulado, indica un complejo hexaammin Co(II) hexacoordinado .
El grupo hexaammin con su mayor interacción, aumenta la energía de desdoblamiento de niveles, con lo que el complejo absorbe en rojo y presenta la coloración azul verdosa que aparece en la fig.14, que corresponde a una disposición octaédrica de los grupos NH3 en el complejo (fig.11)
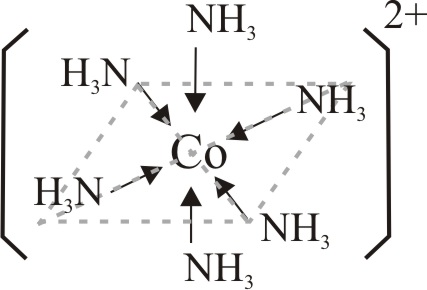
Fig.11

Fig.12
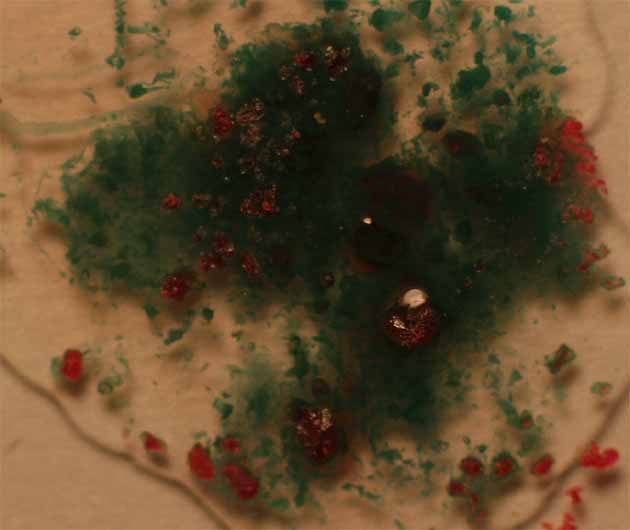
Fig.13
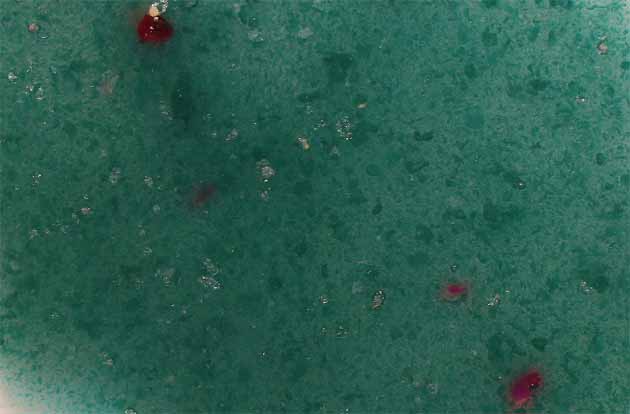
Fig.14
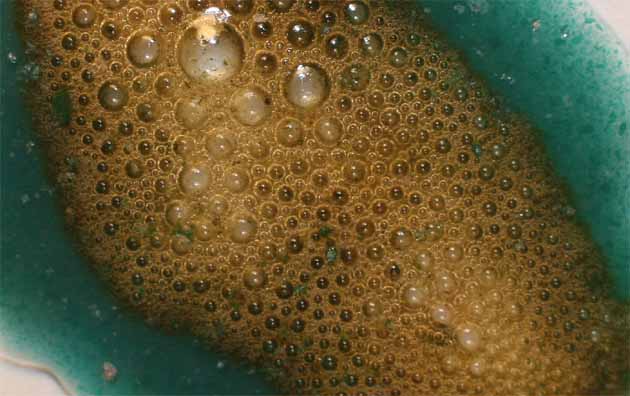
Fig.15
La oxidación con agua oxigenada (fig 15), con gran desprendimiento de oxígeno, garantía de la oxidación del Co(II) a Co(III), va a producir una mezcla de compuestos (coloración de amarilla a pardo-marrón) (fig.15 y 18) .
La coloración amarilla se debe al cloruro de hexaammincobalto(III) (fig 16), compuesto que lógicamente se deberá formar, pero la pardo oscura, se debe a un compuesto, ya estudiado por Werner, con un puente peroxo, procedente del agua oxigenada, entre los dos iones cobalto, de fórmula y estructura dada en la fig.17.
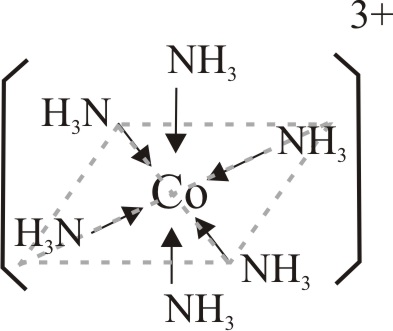
Fig.16
Después al agregar HCl concentrado,
la sustitución de ligandos NH3 por Cl, da lugar a dos cloruros
de diclorotetraammín cobalto(III), uno trans de color verde (fig.19 Y 20) situación
lógica, ya la mayor estabilidad del complejo hace que el nivel t2g tenga menor energía y por lo tanto el salto al eg sea
mayor y otro cis de color violeta (fig23), en la que aparece cristalizado
al cabo de cierto tiempo.
La sucesión de fotos de lo expuesto corresponden a las figuras 18 a 23.

Fig.18

Fig.19

Fig.20
Fig.21
Fig.22
Fig.23
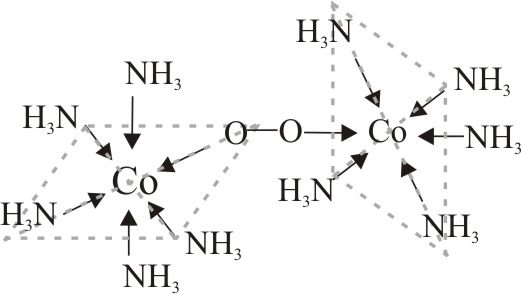 Fig.17
Fig.17
Por lo tanto la energía de desdoblamiento responsable del color, sólo va a depender de la interacción de los ligandos que sigue la tabla 1, del trabajo “Complejos del cobalto 1”, presentado en el mes anterior.
Para demostrar la formación de complejos coloreados, se parte de nitrato de cobalto (II), dado que es muy soluble con lo cual se puede preparar una disolución saturada muy concentrada.