ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
REACCIÓN ENTRE EL PERMANGANATO POTÁSICO
Y AGUA OXIGENADA EN MEDIO ÁCIDO
1. Permanganato potásico con agua oxigenada al 6% en medio sulfúrico 6N
a) Se unen las gotas formadas
por los reaccionantes
conforme lo explicado en la introducción al tema.
b) Aparece un coloración rosa-rojiza, y el desprendimiento característico
de burbujas. Una posible interpretación de la aparición de estos colores
(de las muchas que se pueden hacer), de acuerdo con los diferentes potenciales de
reducción (se debe tener en cuenta que las condiciones reales de la reacción
tampoco son las normales), es que
se forma la sal de manganeso(III), por reducción del permanganato potásico,
y se desprende oxígeno desde el agua oxigenada. El cambio de color desde
púrpura a rojizo se debe a la mezcla de colores con el
rosa.
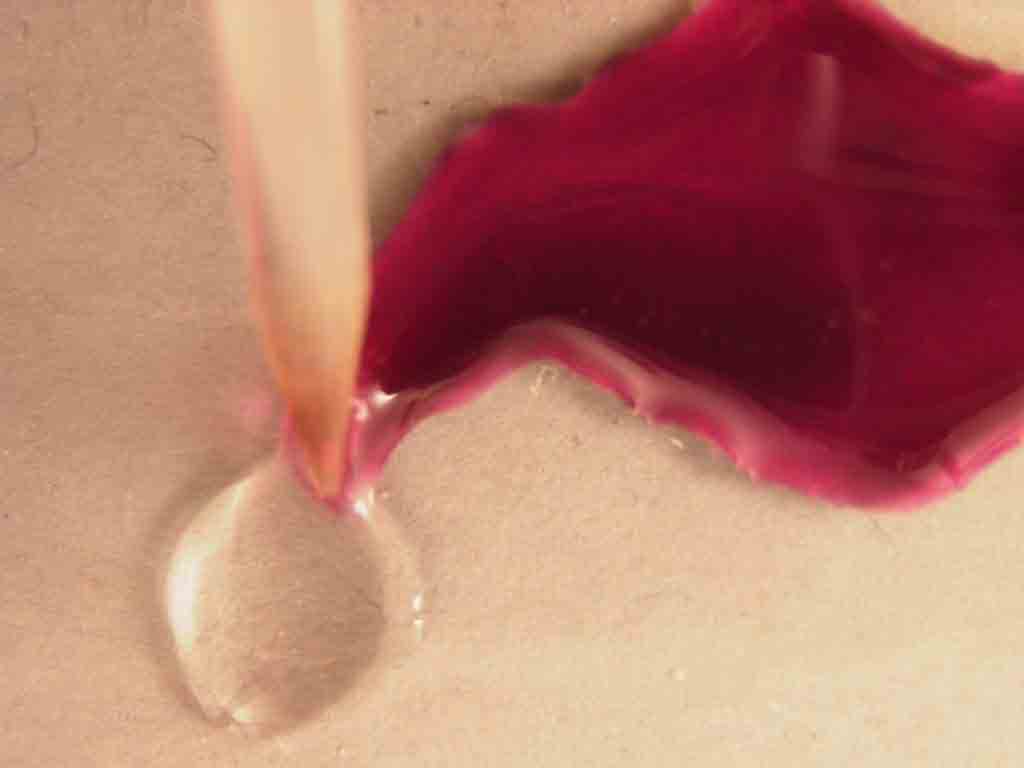
foto 1

foto 2
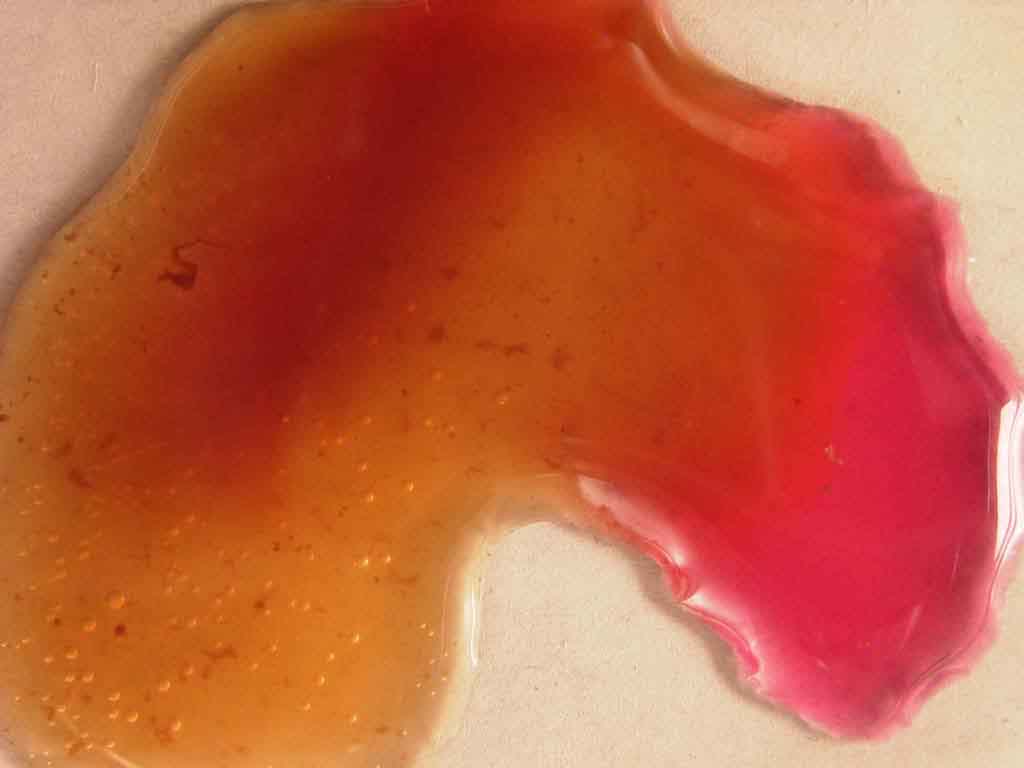
foto 3
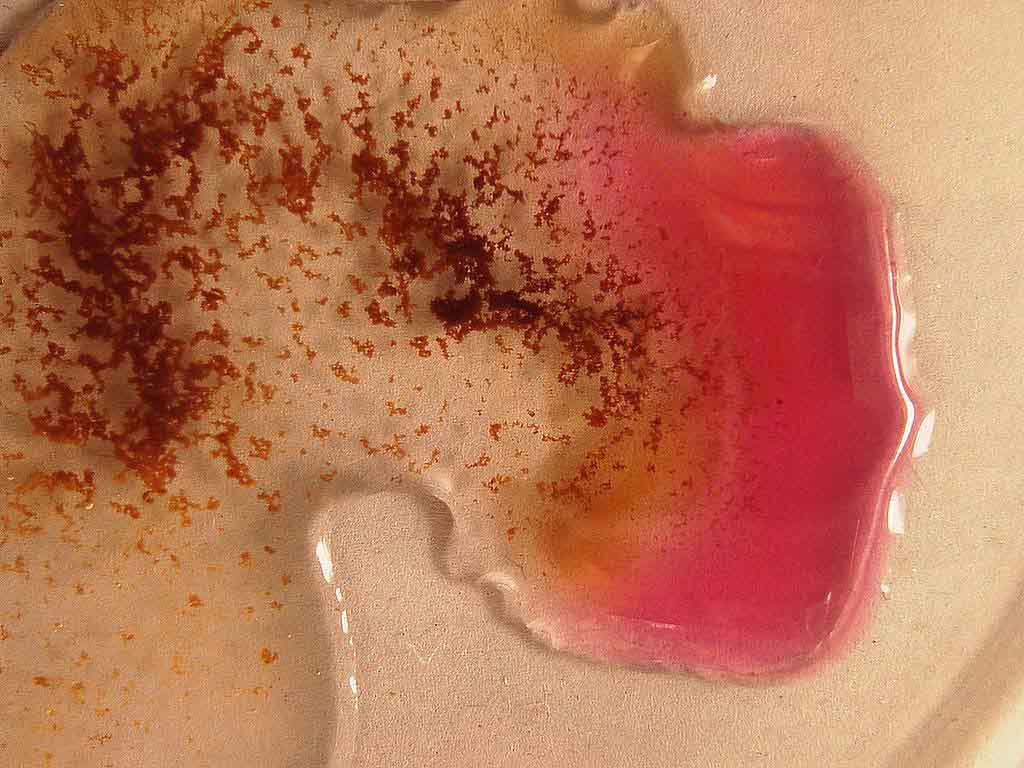
foto 4
c) El
proceso de formación del Mn(III), sería:
REDUC. 2KMnO4 + 4SO4 2- + 8e- + 16H+ = Mn2(SO4)3 + 8H2O +2K+ + SO4 2-
E0= 1,51V
OXIDAC: 4H2O2 - 8e- = 4O2 + 8H+
E0= 0,68V
__________________________________________________________
2KMnO4 + 4H2O2 + 4H2SO4 ![]() Mn2(SO4)3
+4O2+8H2O + K2SO4
Mn2(SO4)3
+4O2+8H2O + K2SO4
2MnO4 - +4H2O2 +8H3O+
![]() 2Mn3++4O2
+16H2O
2Mn3++4O2
+16H2O
Ahora bien el Mn3+,
en medio ácido es inestable, y rápidamente desparece ya por desproporción
en Mn4+ y Mn2+, ya por por reducción a Mn2+,
por acción de la propia agua oxigenada. Igualmente la presencia de Mn2+,
cataliza la descomposición del agua oxigenada, aumentando el desprendimiento
de oxígeno.
d) En las fotografías (3 y
4) se observa como se va oscureciendo la tonalidad, aumentando la producción
de burbujas, formándose un precipitado marrón y desapareciendo el color
naranja.
La formación del Mn2+
(con desaparición del Mn3+) y la aparición del MnO2
(marrón oscuro), de acuerdo con lo ya mencionado se podría interpretar
mediante los procesos:
REDUCC: 2KMnO4 +
3SO4 2- + 16H+ +10e- = 2MnSO4+
8H2O+K2SO4 + 6SO4 2-
OXIDAC: 5H2O2
- 10e- = 5O2 + 10H+
______________________________________________________________
2KMnO4 +
3H2SO4 + 5H2O2 ![]() 2MnSO4 + 8H2O + K2SO4 +
5O2
2MnSO4 + 8H2O + K2SO4 +
5O2
o en forma iónica
2MnO4- + 5H2O2 + 6H3O+
![]() 5O2
+ 2Mn2+ + 14H2O
5O2
+ 2Mn2+ + 14H2O
Pero el Mn(II), también cataliza
la formación del MnO2, a partir del KMnO4, por lo
que se producirá el precipitado marrón oscuro según el proceso:
2KMnO4
+3MnSO4 + 2H2O ![]() 5MnO2 + K2SO4 + 2H2SO4
5MnO2 + K2SO4 + 2H2SO4
2. Permanganato
potásico con sulfato de manganeso(II) en medio neutro
Se sigue la técnica anterior obteniéndose
esta sucesión de fotografías en 30 segundos:

foto 5
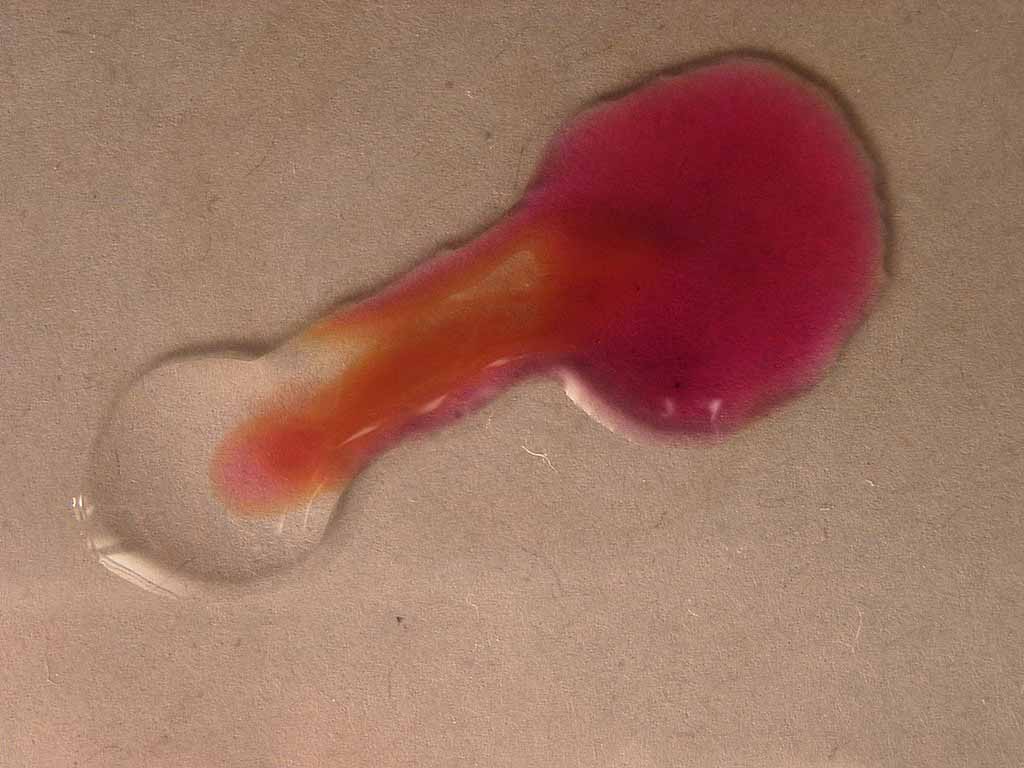
foto 6

foto 7
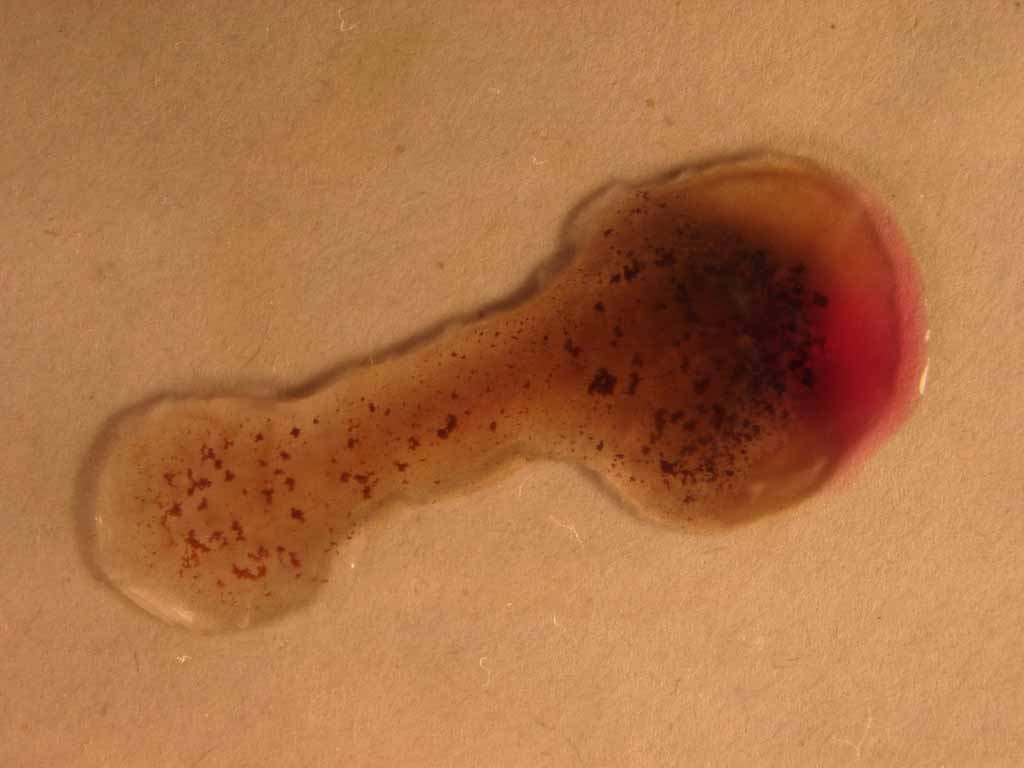
foto 8
Por lo tanto la reacción que podrá justificar
este hecho será:
REDUCC.
2KMnO4 + 8HSO4 - + 6e- = 2MnO2 + 4H2O +2K+ + 8SO4 2-
OXIDAC.
3Mn2+ + 6H2O + 12SO4 2- - 6e- = 3MnO2 + 12HSO4 -
_______________________________________________________________
2KMnO4 + 3MnSO4 +2H2O + K2SO4 ![]() 5MnO2 + 4KHSO4
5MnO2 + 4KHSO4
o en forma iónica
2MnO4 - +3Mn2+ +2H2O + 4SO4 2- ![]() 5MnO2 + 4HSO4 -
5MnO2 + 4HSO4 -