
Tabla 1
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
Complejos
del Cobalto 1
Los compuestos de coordinación
del cobalto(II) , no tan conocidos como los de Co(III) que fueron los primeros
estudiados, son también importantes, dado que el ion dispone de 7 electrones
en los orbitales 3d, ello hace que el
desdoblamiento de esos orbitales en función de la interacción con los ligandos,
grupos con pares de electrones solitarios, permita saltos electrónicos por
absorción de energía luminosa en el espectro visible, que provoca que el compuesto tome colores complementarios espectaculares,
muy apropiados para ser visionados en foto
digital.
La serie espectroquímica de Tsuchida,
clasifica los ligandos por su interacción con los iones centrales, en este
caso el Co(II), sería I- <Br-<Cl-<F-<
R-OH< H2O< NCS-<NH3<CN-
Cuanto mayor sea la interacción con los orbitales d, según su orientación espacial, mayor desdoblamiento, y por lo tanto , mayor será la diferencia energética ), mayor la frecuencia L de la radiación absorbida, menor su longitud de onda 8. En función de eso la radiación absorbida, los colores que se observan vienen dados en la tabla 1

Tabla 1
Sin embargo todavía pueden producirse
modificaciones en las energías absorbidas, en este caso, dado que los ligandos,
pueden tomar una disposición alrededor del Co(II),
octaédrica y si la distorsión de los ligandos es grande, tetraédrica e incluso
cuadrado plana, dando lugar a diferentes desdoblamientos orbitales.
La distribución energética de los 7 electrones d, del Co(II),
según el tipo de disposición viene
dada en las fig 1, 2 y 3:
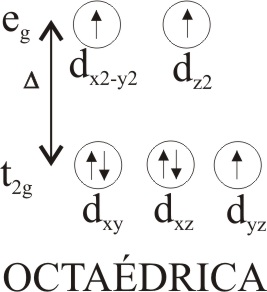
Fig.1
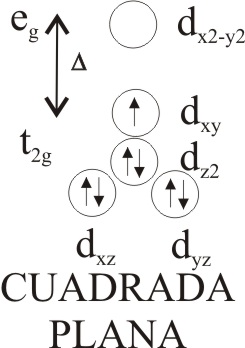
Fig.3
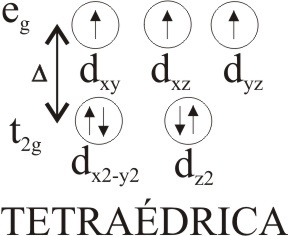
Fig.2
Las dos primeras correspondería a situaciones de alto spin, mientras que la
última sería de bajo spin, como se comprueba experimentalmente. La octaédrica
implicaría mayor absorción de energía para que los electrones salten (colores
de complejos del rosa al púrpura), mientras que la cuadrada y la tetraédrica,
implican una menor absorción de energía (colores de complejos azul e índigo)
Para demostrar la formación de complejos coloreados, se parte de nitrato de cobalto (II), dado que es muy soluble con lo cual se puede preparar una disolución saturada muy concentrada. Para eso se agrega una gota de agua al producto sólido, y otra al tiocianato potásico (fig 4), evolucionado el sistema al difundirse el tiocianato sobre la disolución de nitrato de cobalto(II) ( fig 5, 6, 7 y 8), formándose un complejo azul oscuro, cuyo detalle vemos en la fig.9

Fig.4
Fig.5
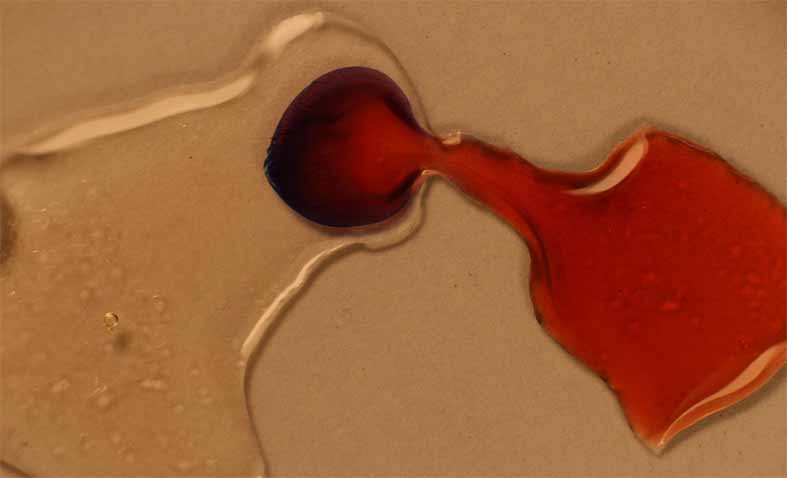
Fig.6
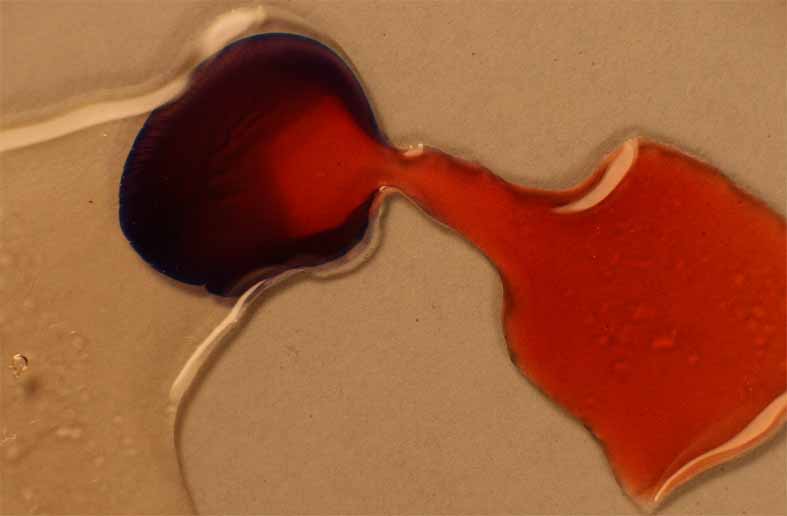
Fig.7
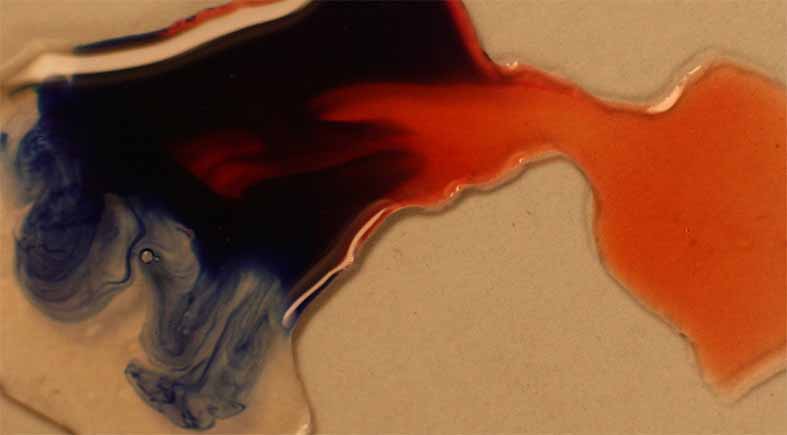
Fig.8
Fig.9 (detalle)
Las reacciones que tienen lugar con formación de estos compuestos complejos coloreados serían:
En primer lugar la formación de un complejo plano azul oscuro de tetratiocianocobalto(II)
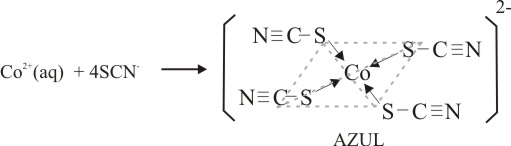
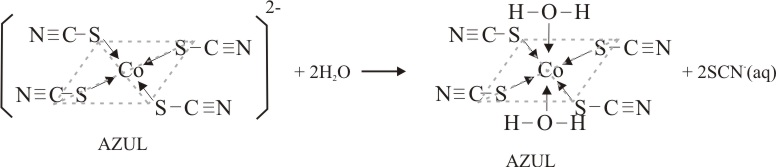
Como se observa en las fig 8 y 9.
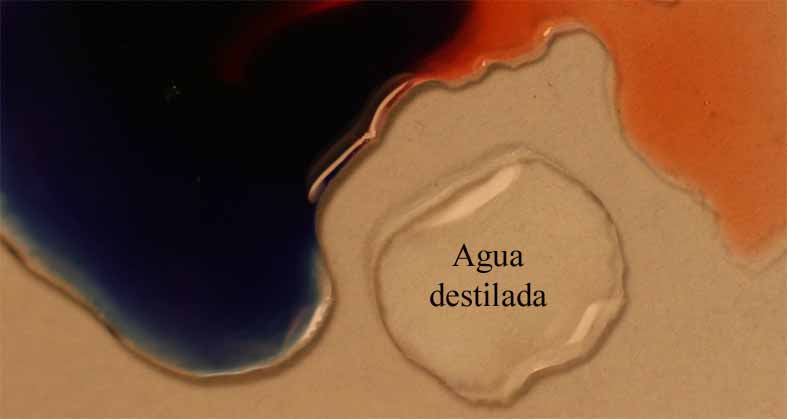
Fig.10
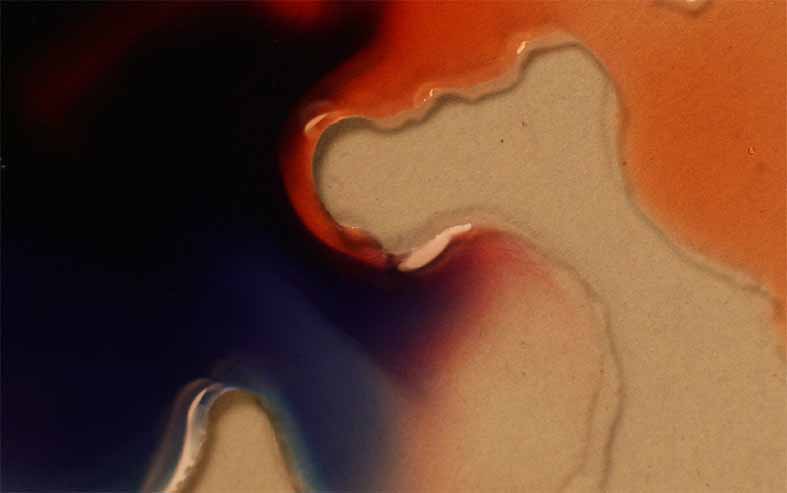
Fig.11
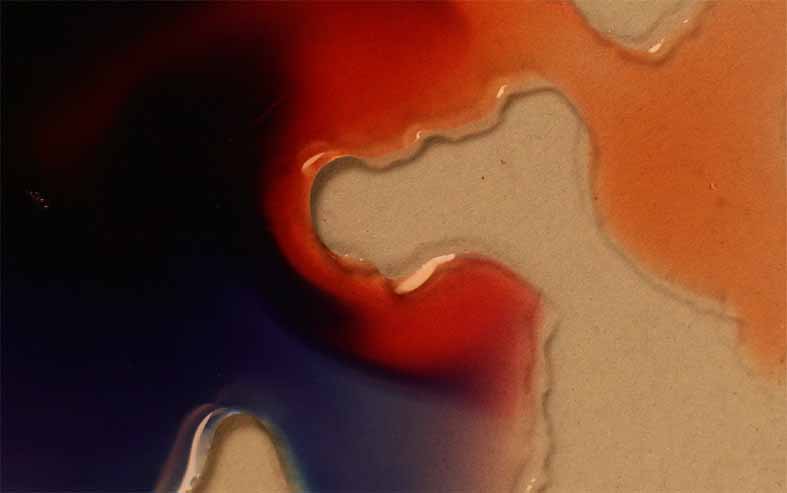
Fig.12
Fig.13 (detalle)

Fig.14

Fig.15
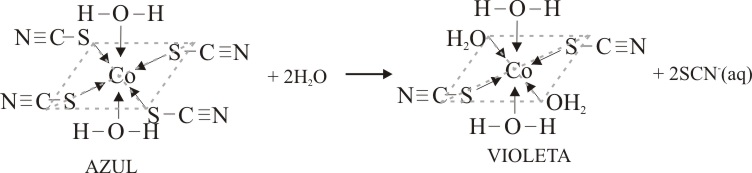
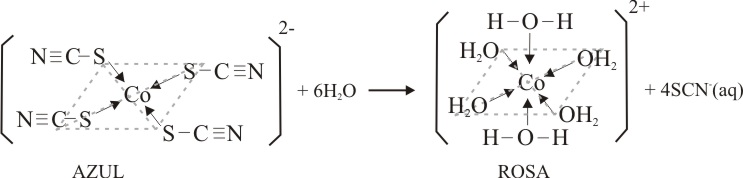
Solamente al final de la jornada
cuando predomina una única especie, se pueden obtener colores definidos como
los que se presentan, correspondiente al tetraacuoditiocianocobalto(II)
(fig 14) y hexaacuo-cobalto(II) (fig.15)
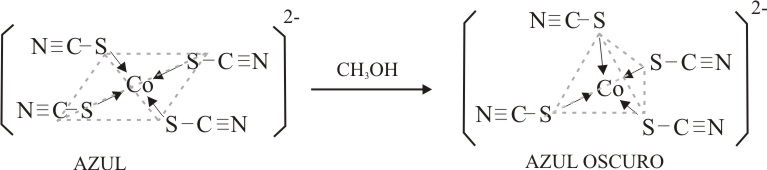
Fig.16
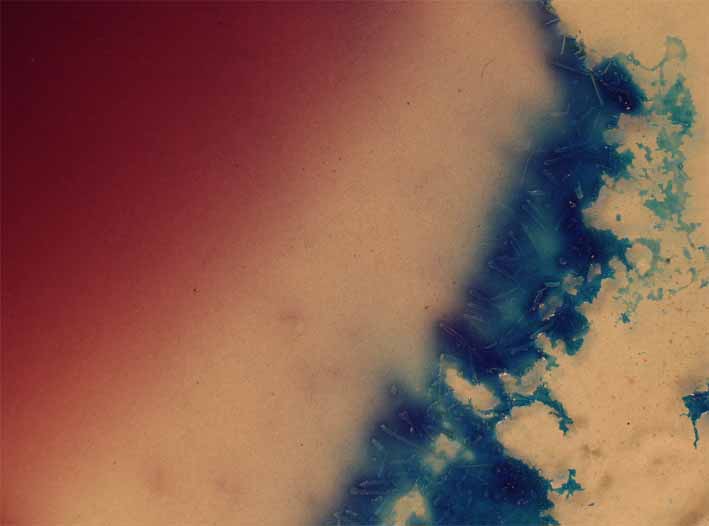
Fig.17
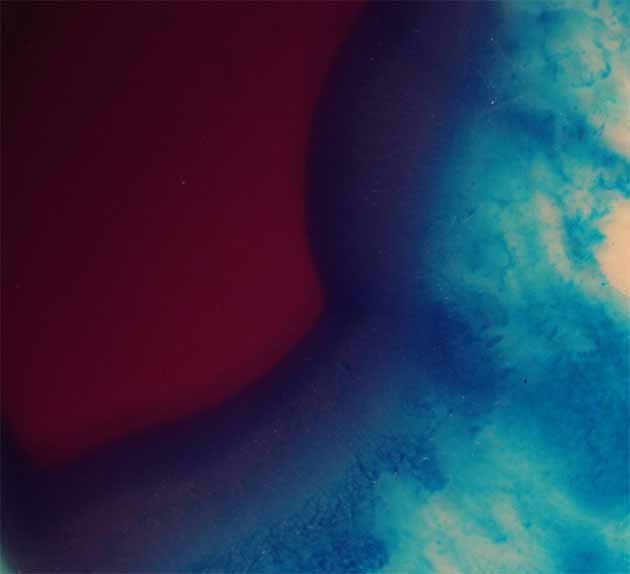
Fig.18

Fig.19

Fig.20