Fig.1
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
REACCIONES REDOX CON
NITRITOS
Por lo general se ha considerado
a los nitritos como agentes reductores, que fácilmente se oxidaban a nitratos,
sin embargo en este trabajo veremos como también pueden ser oxidantes.
a) Reacción con permanganato potásico en medio ácido
Para estudiar su comportamiento como reductor, se puede emplear
su reacción con permanganato potásico en medio ácido. Para ello en la química a la gota, se emplea sólo 2 o
3 cristalitos de permanganato potásico puro, que se disuelve en una gota de
agua destilada, formando la gota del agente oxidante, mientras que unos cristalitos
de nitrito sódico disueltos en agua destilada, con una gota de ácido sulfúrico,
será la gota del agente reductor (fig.1)
Fig.1
Fig.3
Fig.4
Fig.5
Dado que el ácido empleado para acidificar
el nitrito, es el sulfúrico,al mezclarse (fig.2),
enseguida se forma sulfato de manganeso(II) incoloro (fig.5), que apenas se
nota, y pero también el nitrito se desproporciona a óxido nítrico y nitrato
sódico, por lo que aparecen las burbujas características de NO (g) ( fig.3),
según los dos procesos simultáneos:
2KMnO4
+ 5NaNO2+ 3H2SO4 ![]() 2MnSO4 +5NaNO3+
K2SO4 +3H2O
2MnSO4 +5NaNO3+
K2SO4 +3H2O
3NaNO2 + H2SO4 ![]() NaNO3 + 2NO (g)+ Na2SO4 + H2O
NaNO3 + 2NO (g)+ Na2SO4 + H2O
Teniendo en cuenta que las sales
y ácidos fuertes están completamente disociados en disolución los proce-sos
redox detallados serían:
Proceso 1:
REDUCC: 2MnO4 -+ 16H+ + 10e- = 2Mn2+ + 8 H2O
OXIDAC: 5 NO2- +5 H2O -10e- = 5 NO3- + 10H+
Proceso que en forma
molecular se completaría:
KMnO4 +5 NaNO2
+3H2SO4 ![]() 2MnSO4 + K2SO4
+ 5 NaNO3 + 3H2O
2MnSO4 + K2SO4
+ 5 NaNO3 + 3H2O
Púrpura incoloro
Proceso 2:
REDUCC: 2NO2- +4H+ + 2e = 2NO (g) + 2H2O
OXIDAC: NO2- + H2O - 2e = NO3-+ 2H+
Completándolo
en forma molecular : 3NaNO2
+H2SO4 ![]() 2NO
(g) + H2O + NaNO3 + Na2SO4
2NO
(g) + H2O + NaNO3 + Na2SO4
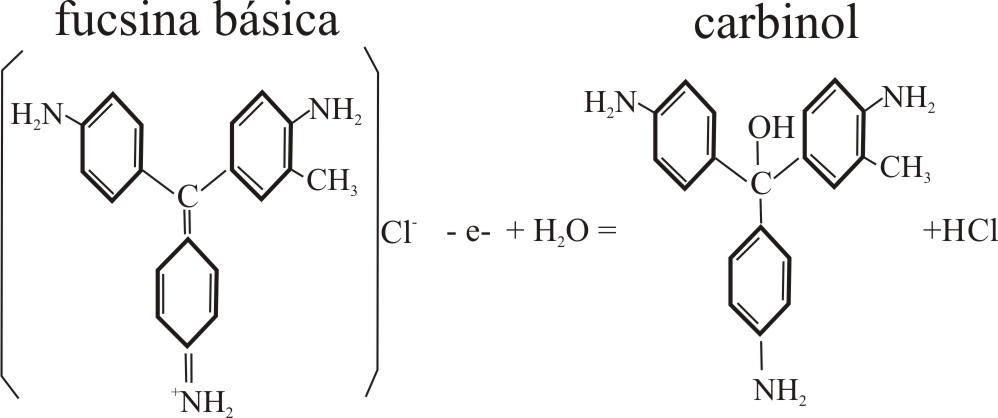
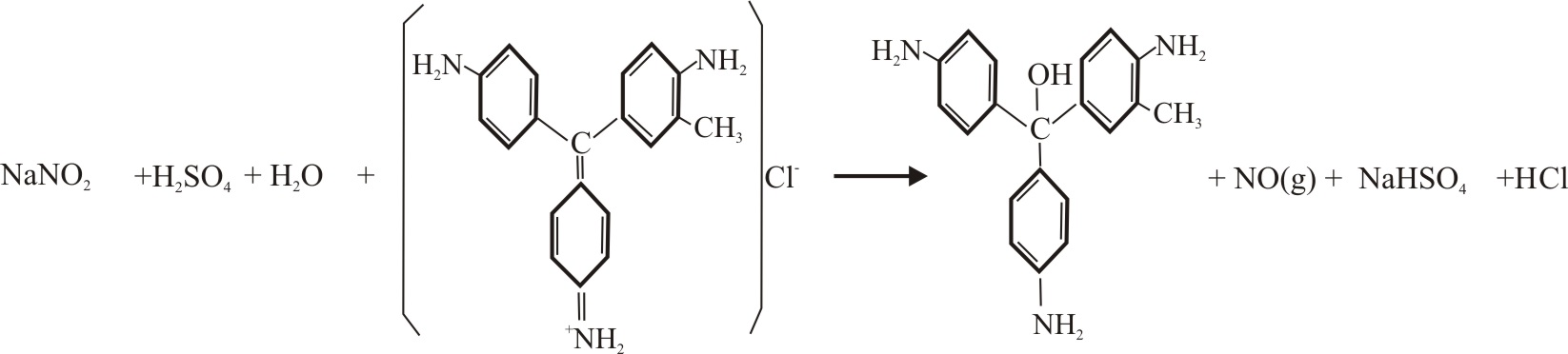
2) Reacción con fucsina básica
En la reacción
de los nitritos en medio sulfúrico con la fucsina básica, actúan como oxidantes
de la fucsina, para eso se ponen en comunicación las gotas tal como indica
la fig 6, y se observan los cambios
de color de la fucsina. En el proceso se nota el desprendimiento de NO(g),
dentro de la reducción del nitrito, y también
la desproporción del nitrito según el proceso 2 de la reacción anterior.
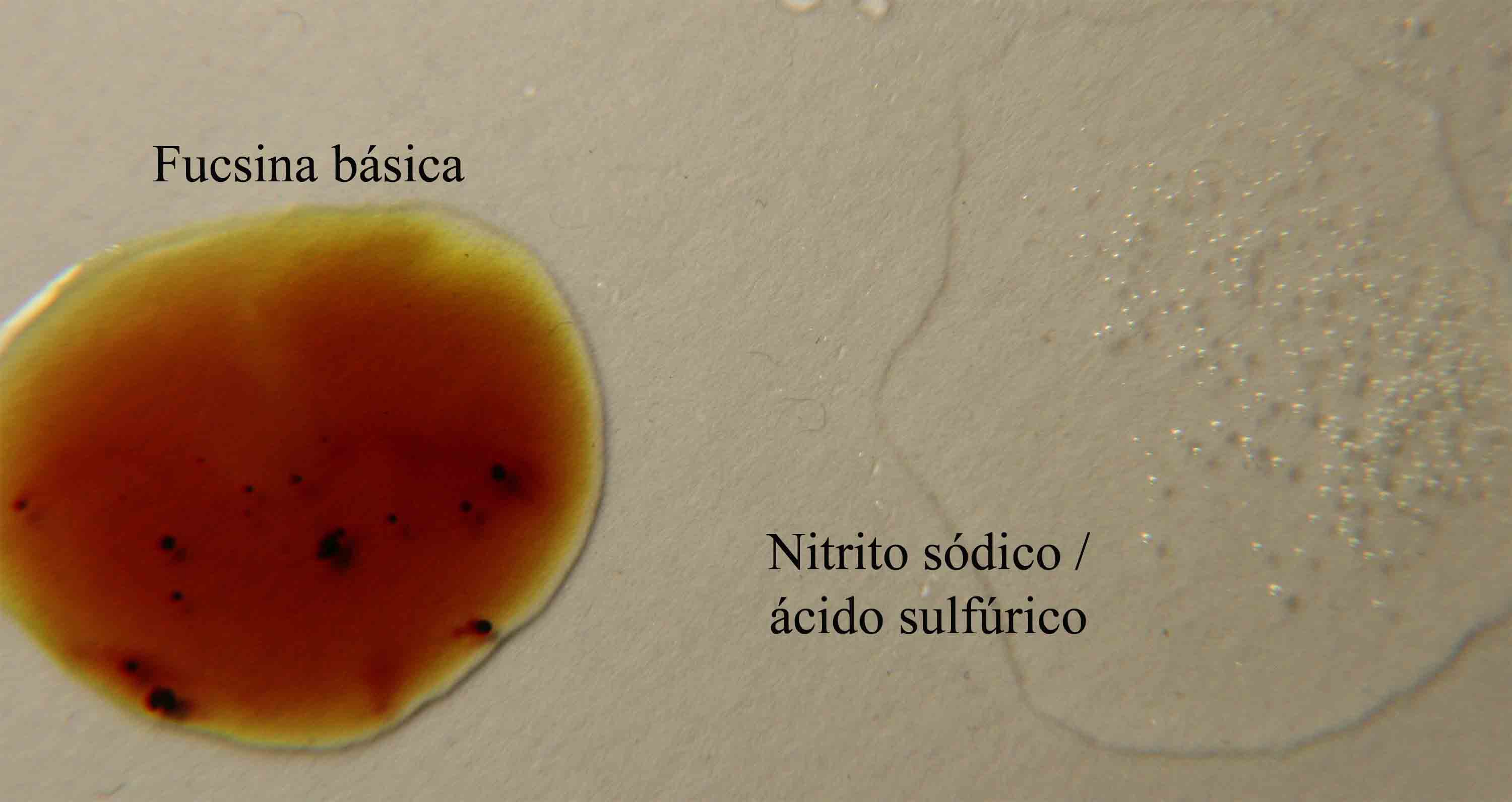
Fig.6
Fig.7
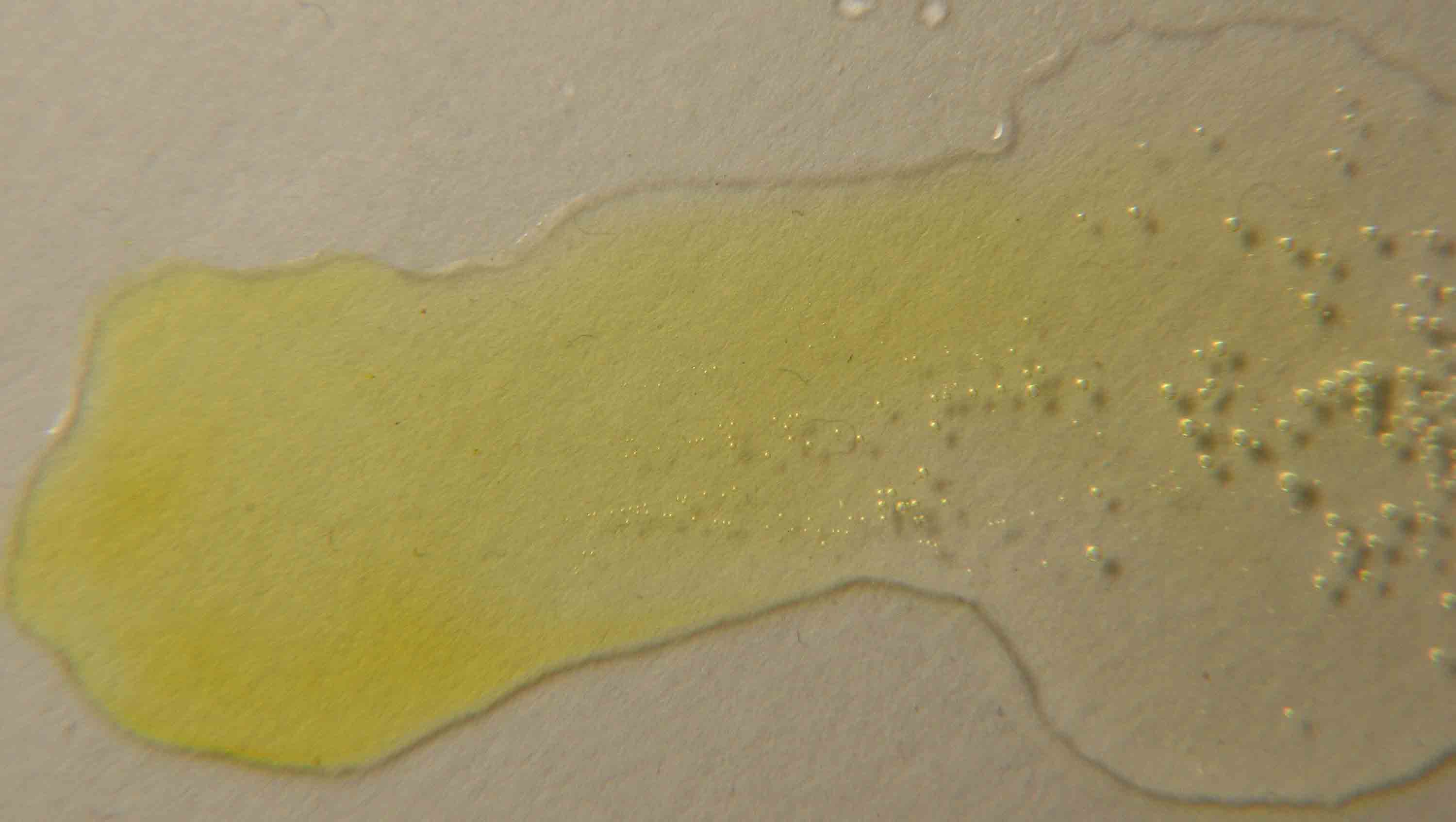
Fig.8

Fig.9

Fig.10
Los procesos redox detallados serían:
Proceso
1:
REDUCC:
NO2- +2H+
+ e- = NO (g) + H2O