
Fig.1
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
FORMACIÓN DE HIDROXIÓXIDOS
DE ALGUNOS METALES DE TRANSICIÓN
La formación de hidroxióxidos de hierro, manganeso y cobalto, es mucho mas frecuente de lo que se creee. Debe procurarse un medio fuertemente alcalino, y oxidar los hidróxidos metálicos en su estado de oxidación inferior, con un oxidante no excesivamente fuerte. En estas condiciones se consiguen.
En el desarrollo de química a
la gota que efectuamos, partiremos de sales corrientes como sulfato de hierro
(II), cloruro de cobalto(II) y sulfato de manganeso(II),
para obtener los hidroxióxidos correspondientes de hierro(III), cobalto(III)
y manganeso(III)
1) La primera reacción a estudiar
será el tratamiento de sulfatode hierro(II) con hidróxido
sódico y posterior oxidación con peróxido de hidrógeno
La secuencia de fotos la forman las figuras 1, 2, 3 , 4, 5 y 6 , siguiendo el procedimiento de difusión de gotas que se ha empleado en todos los desarrollos de esta sección

Fig.1

Fig.2

Fig.3

Fig.4
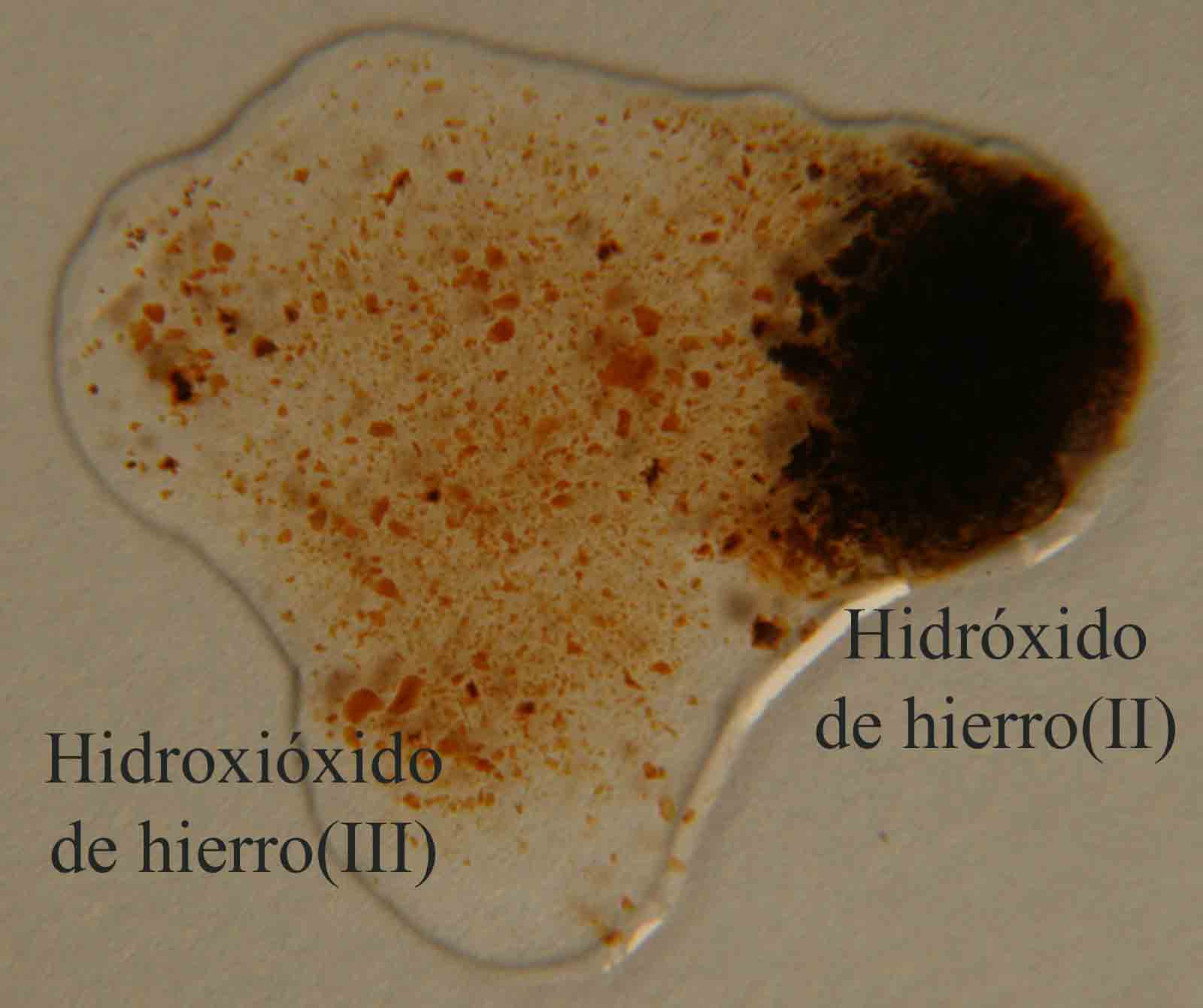
Fig.5

Fig.6
Los procesos químicos que ocurren en las fotos anteriores
son:
En la figura 1, se disponen las gotas de los reaccionantes,
el hidróxido sódico 6M, y el sulfato de hierro(II),
amarillento.
En las figuras 2 y 3, se produce un proceso de precipitación con formación de
un hidróxido insoluble de acuerdo con la siguiente reacción:
FeSO4 + 2NaOH)2 ![]() Fe(OH)2+
Na2SO4
Fe(OH)2+
Na2SO4
En la figura
4, el hidróxido de hierro(II) sólido, de color marrón
muy oscuro, se dispone junto con la gota del oxidante, en este caso peróxido
de hidrógeno 3%, produciendose al comunicarse las gotas, el proceso redox
con formación de hidroxióxido de hierro(III) sólido (fig 5 y 6).
El proceso elemental sería:
2Fe(OH)2 + H2O2
2FeO(OH) + 2 H2O
REDUCC: H2O2 +2e-
= 2OH-
OXIDAC:
__________________________________________
2Fe(OH)2 + H2O2 = 2FeO(OH) + 2 H2O
marrón oscuro marrón anaranjado
2) Reacción del
cloruro de cobalto(II), con hidróxido sódico 6M,
y posterior oxidación del hidróxido de cobalto(II) con peróxido de hidrógeno
3% hasta formar hidroxióxido de cobalto(III). La sucesión de fotos que visualiza
estas reacciones corresponde a las
figuras 7, 8 ,9,10,11 y 12.
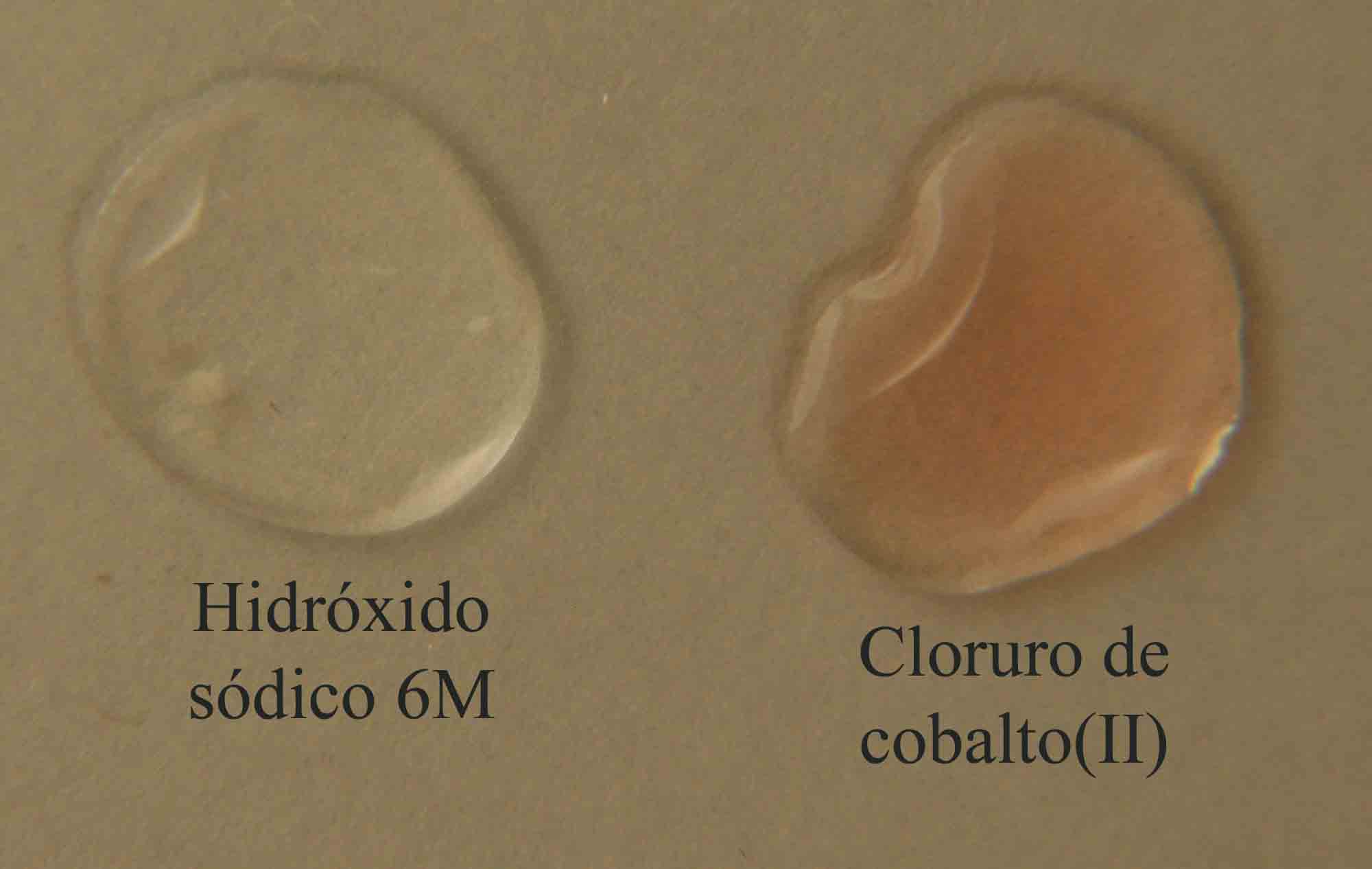
Fig.7
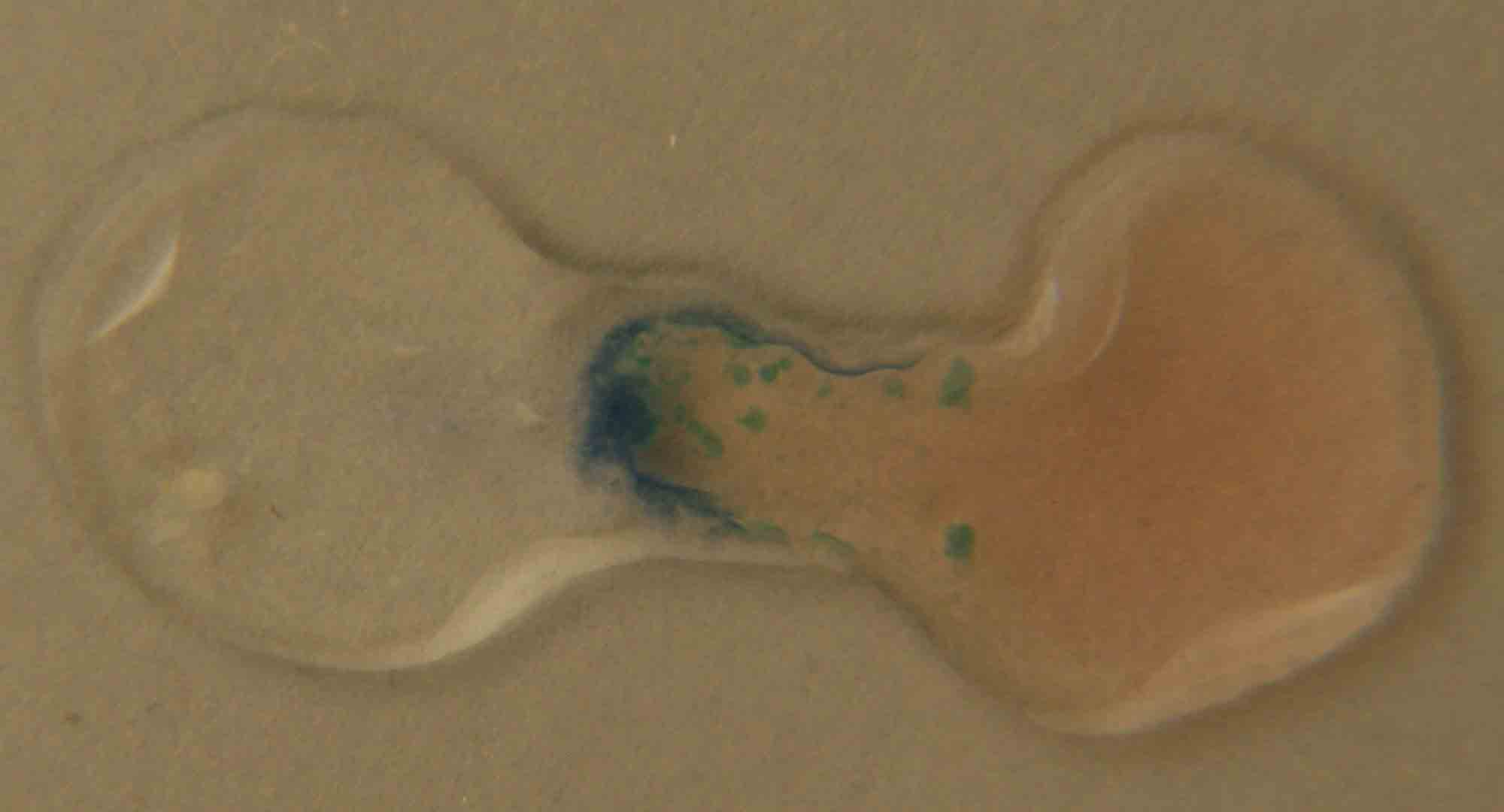
Fig.8
Fg.9
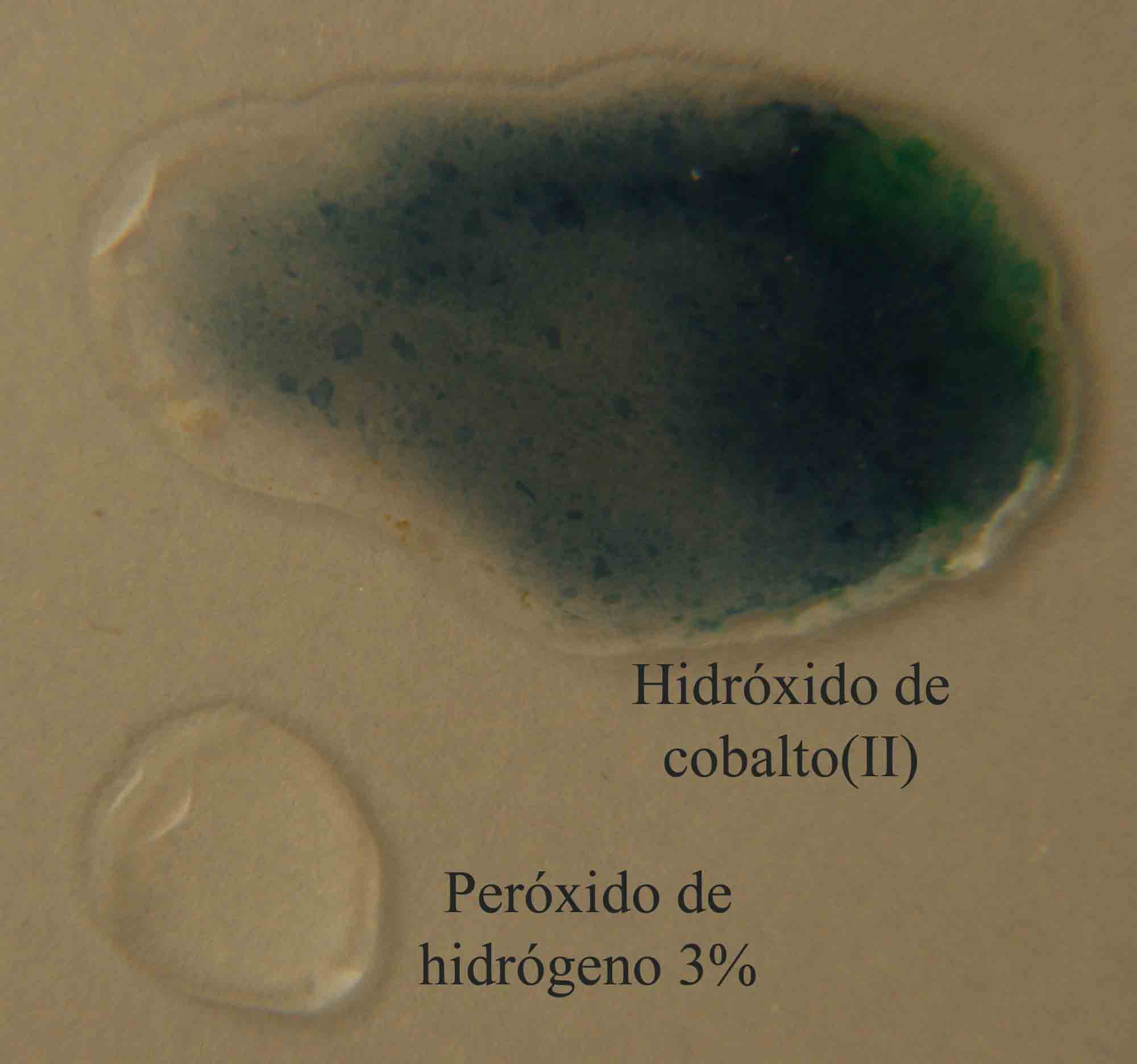
Fig.10
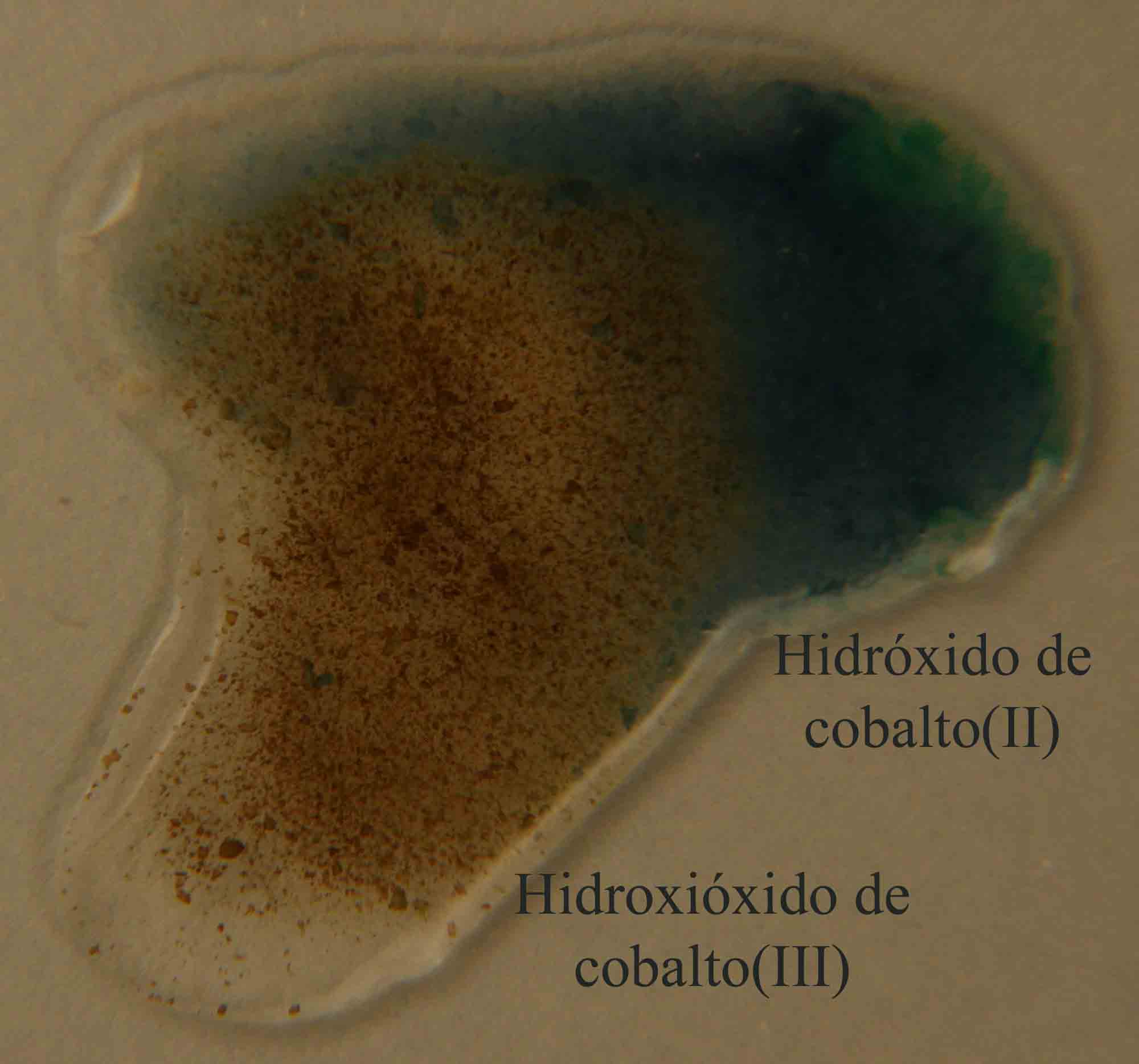
Fig.11
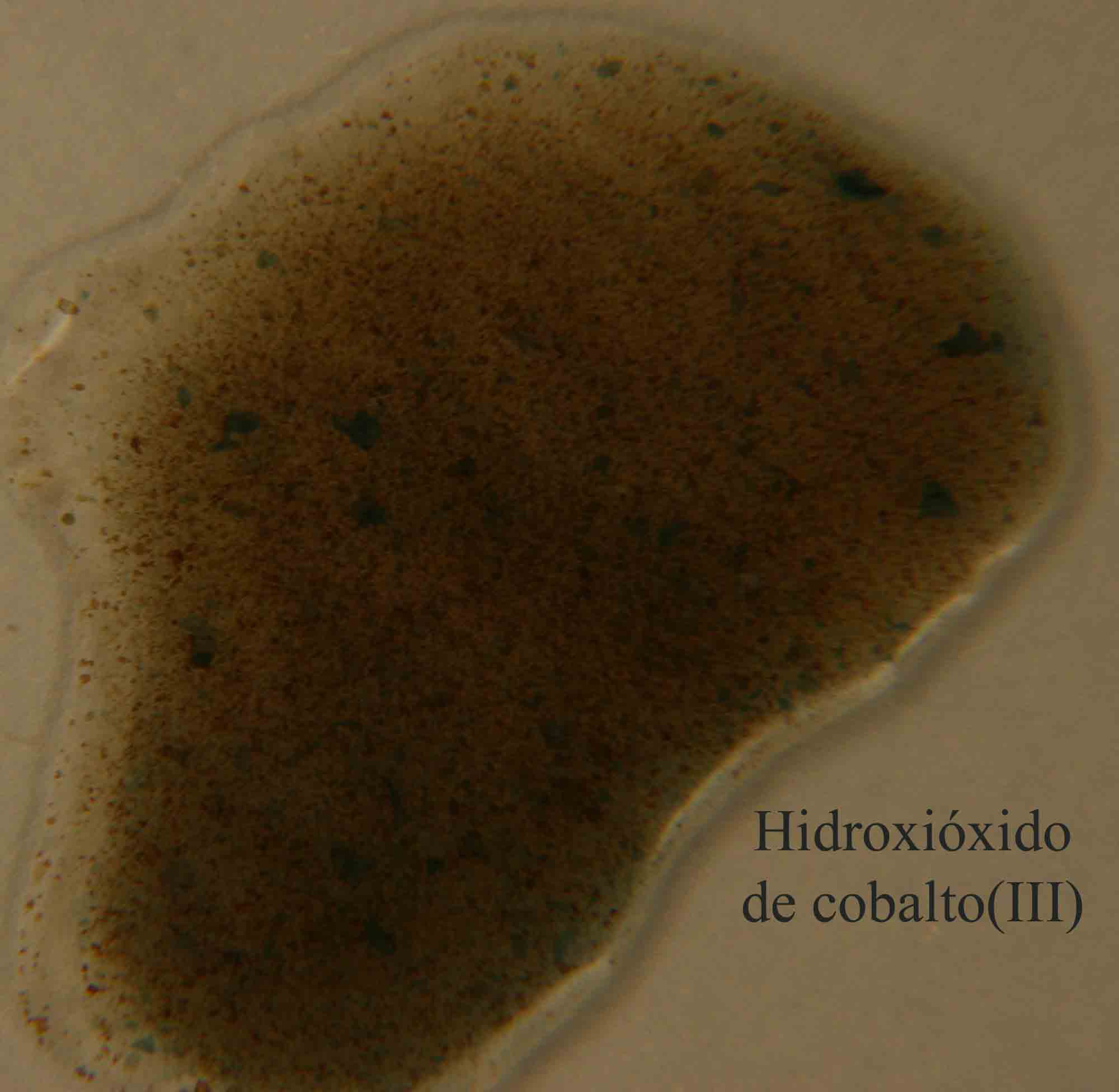
Fig.12
Los procesos químicos que ocurren en las fotos anteriores
son:
En la figura 1, se disponen las gotas de los reaccionantes,
el hidróxido sódico 6M, y el cloruro de hierro(II),
rosa.
En las figuras 8 y 9, se produce un proceso de precipitación con formación de
un hidróxido insoluble de acuerdo con la siguiente reacción:
CoCl2 + 2NaOH)2 ![]() Co(OH)2+ 2NaCl
Co(OH)2+ 2NaCl
En la figura
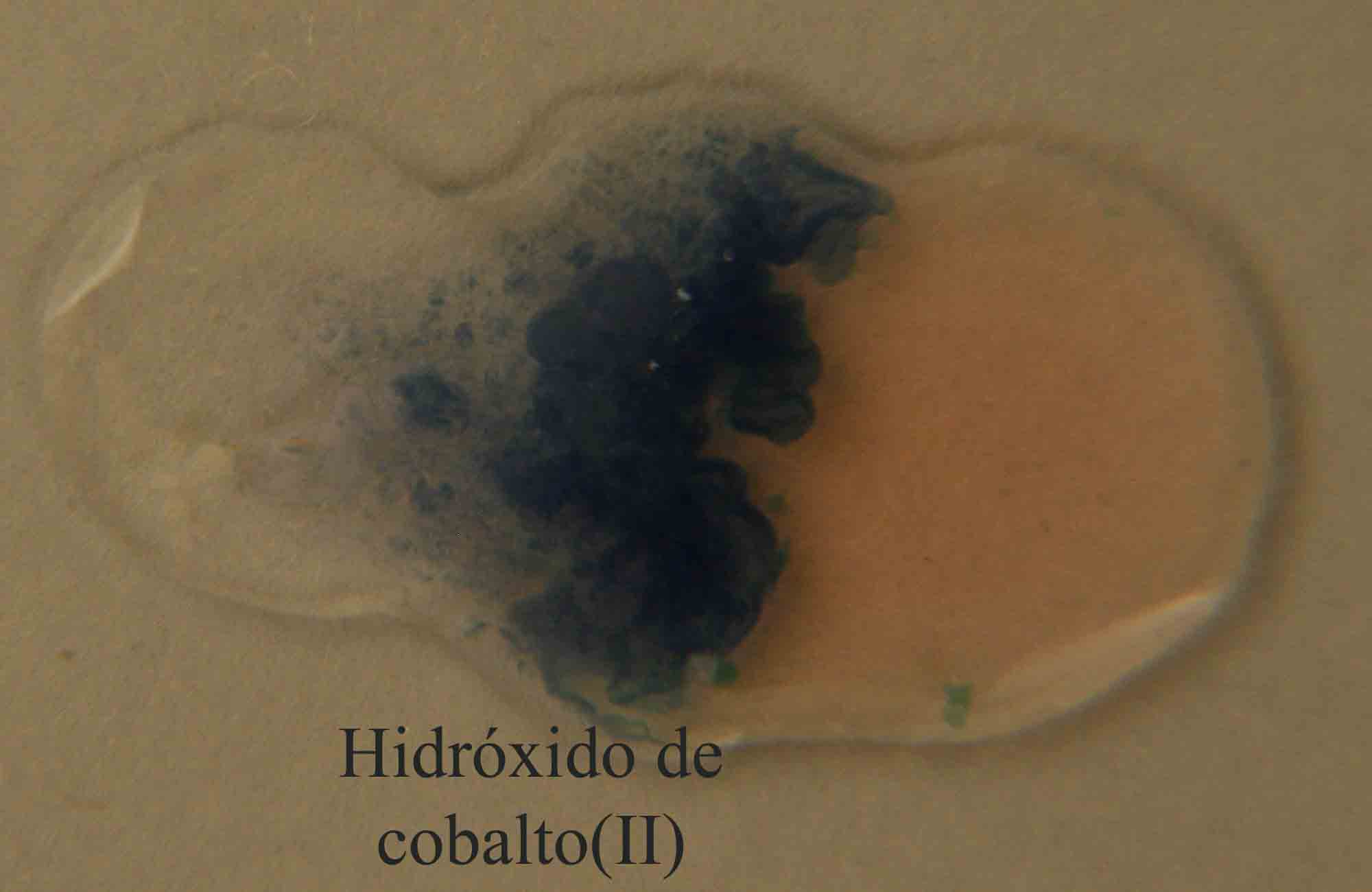
10, el hidróxido de cobalto(II) sólido, de color
azul osuro , se dispone junto con la gota del oxidante, en este caso peróxido
de hidrógeno 3%, produciendose al comunicarse las gotas, el proceso redox
con formación de hidroxióxido de cobalto(III) sólido (fig 11 y 12).
El proceso elemental sería:
2Co(OH)2 + H2O2
2CoO(OH) + 2 H2O
REDUCC: H2O2 +2e-
= 2OH-
OXIDAC:
_____________________________________________
2Co(OH)2 + H2O2 = 2CoO(OH) + 2 H2O
azul verdoso oscuro marrón
negruzco
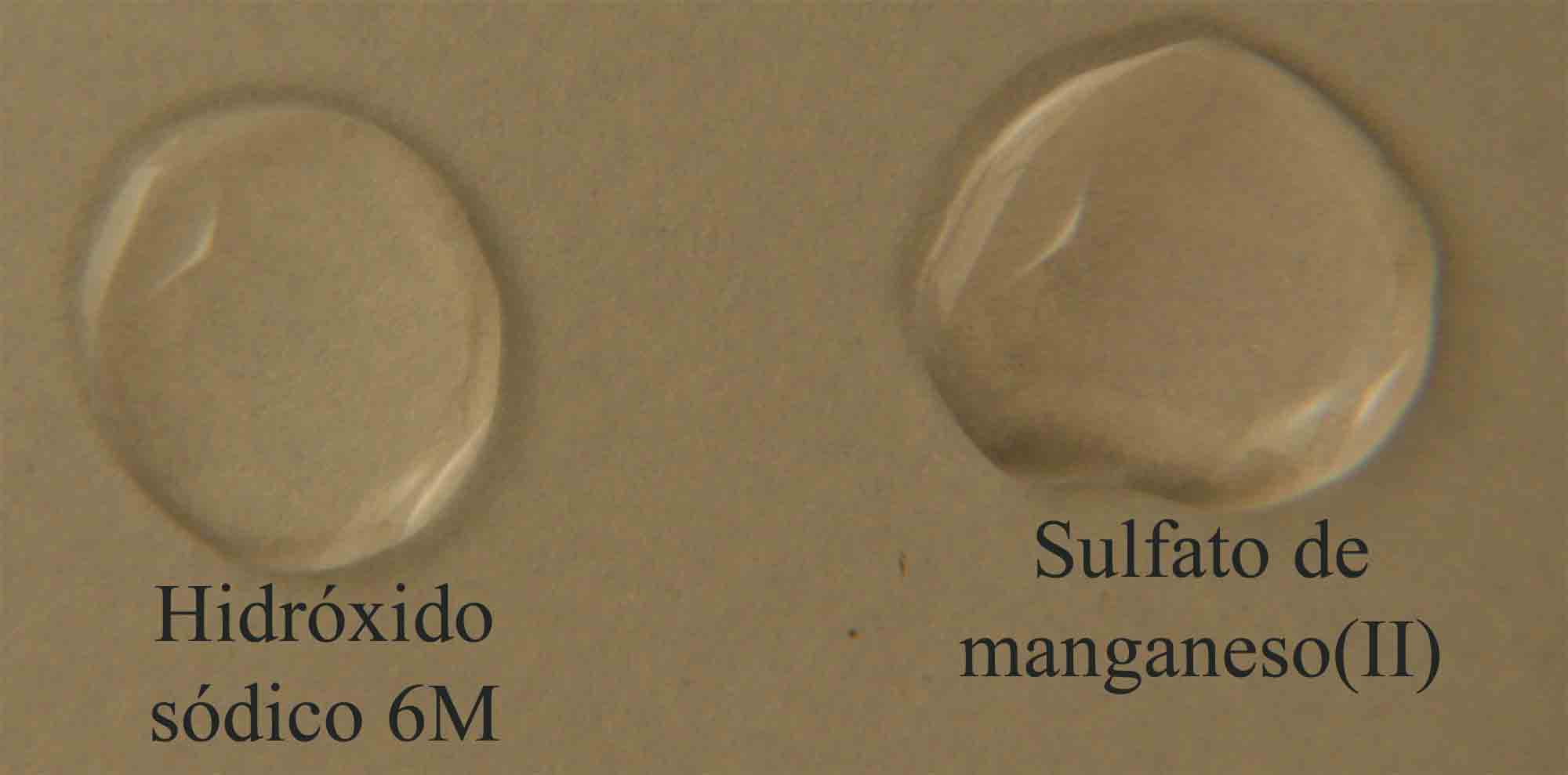
Fig.13
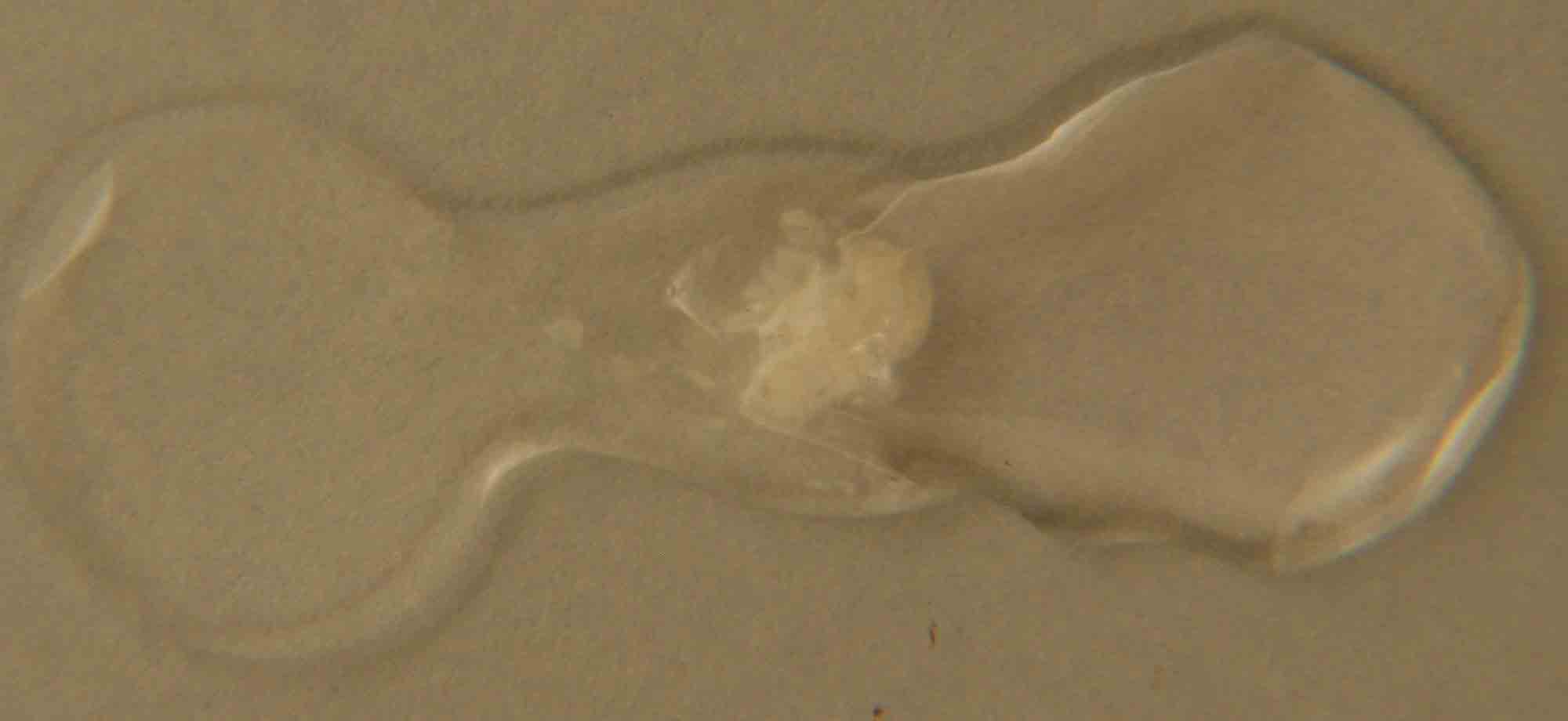
Fig.14

Fig.15

Fig.16
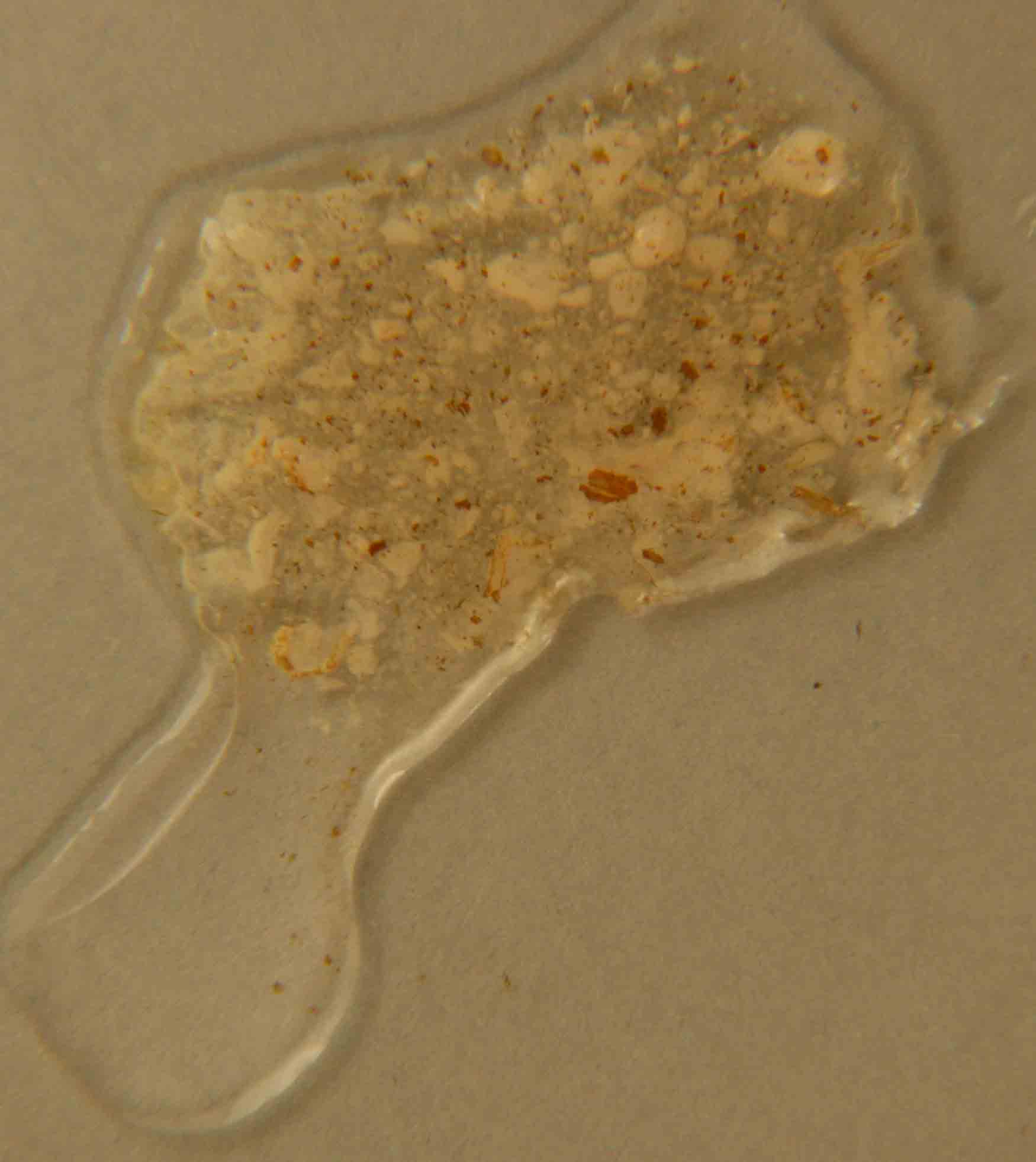
Fig.17
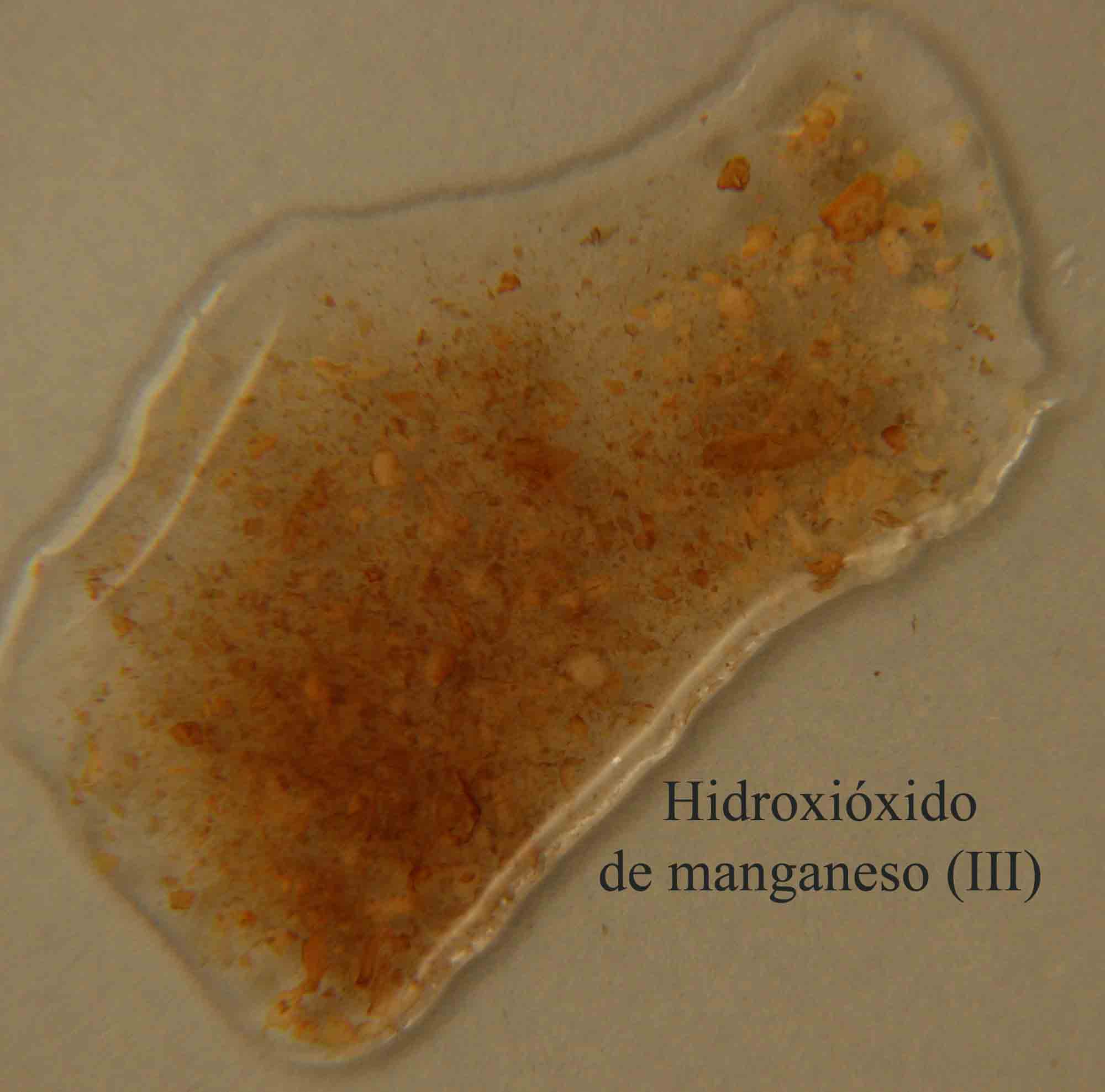
Fig.18
Los procesos químicos que ocurren en las fotos anteriores
son:
En la figura 13, se disponen las gotas de los reaccionantes,
el hidróxido sódico 6M, y el sulfato de manganeso(II),
incoloro.
En las figuras 14 y 15, se produce un proceso de precipitación con formación de
un hidróxido insoluble de acuerdo con la siguiente reacción:
MnSO4 + 2NaOH)2 ![]() Mn(OH)2+ Na2SO4
Mn(OH)2+ Na2SO4
En la figura
16, el hidróxido de manganeso(II) sólido, de color
amarillento, se dispone junto con la gota del oxidante, en este caso peróxido
de hidrógeno 3%, produciendose al comunicarse las gotas, el proceso redox
con formación de hidroxióxido de manganeso(III) sólido (fig 17 y 18).
El proceso elemental sería:
2Mn(OH)2 + H2O2
2MnO(OH) + 2 H2O
REDUCC: H2O2 +2e-
= 2OH-
OXIDAC: 2Mn(OH)2 + 2OH-
- 2e- = 2MnO(OH) + 2 H2O
___________________________________________
2Mn(OH)2 + H2O2 = 2MnO(OH) + 2 H2O
amarillo marrón