
Fig.1
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
REACCIONES REDOX CON
DICROMATO POTÁSICO
Se han comenzado los trabajos
de Química a la gota con las reacciones redox del permanganato potásico, un
oxidante característico y visualmente muy interesante por las tonalidades
de los diferentes estados de oxidación del manganeso. El dicromato potásico,
otro oxidante característico es menos espectacular en sus cambios de color,
y mucho mas restringido (actúa en medio ácido), sin embargo se pueden potenciar
los aspectos visuales en función de los productos obtenidos: gases, complejos
coloreados etc, que pueden dar realce a las reacciones a la gota.
Tiene un problema y es que fácilmente
se convierte en cromato, por eso en numerosas ocasiones, emplearemos unos
cristales de dicromato potásico sólido (naranja), disueltos en una gota de
agua destilada, y a la que se agregará una gota de ácido sulfúrico diluido.
1) La primera reacción a estudiar
será con oxalato sódico sólido
La secuencia de fotos la forman
las figuras 1, 2, 3 y 4 (detalle)

Fig.1


Fig.2


Fig.3

Fig.4
K2Cr2O7
+ 3Na2C2O4+ 7H2SO4
![]() 6CO2 + Cr2(SO4)3+
3Na2SO4 + K2SO4 +7H2O
6CO2 + Cr2(SO4)3+
3Na2SO4 + K2SO4 +7H2O
2) Reacción con
sulfato de hierro(II)(ac).
En este caso se intenta potenciar el color por formación de complejos agregando
posteriormente una gota de disolución
de ferrocianuro potásico. La sucesión
de fotos son las figuras 5,6, y 7. La 8 es un detalle para la mejor apreciación
de los colores.
Fig.5

Fig.6

Fig.7

Fig.8
K2Cr2O7
+ 6FeSO4+ 7H2SO4 ![]() 3Fe2(SO4)3+ Cr2(SO4)3+ K2SO4 +7H2O
3Fe2(SO4)3+ Cr2(SO4)3+ K2SO4 +7H2O
c)
Si en vez de emplear ferrocianuro potásico se usara con el mismo fundamente
el tiocianato potásico, al juntarse las tres gotas, se forma el complejo de
Fe(SCN)2+ adquiriendo una tonalidad rojiza espectacular.
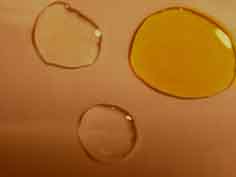
Fig.9

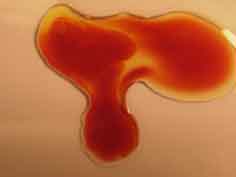
Fig.10

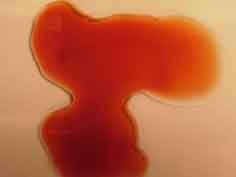
Fig.11


Fig.12
d) Una reacción muy interesante
es la que tiene lugar con yoduro potásico
0,2M, agregando una gota de ácido sulfúrico
6N. (véanse la sucesión de figuras 13,14,15 (ampliación).
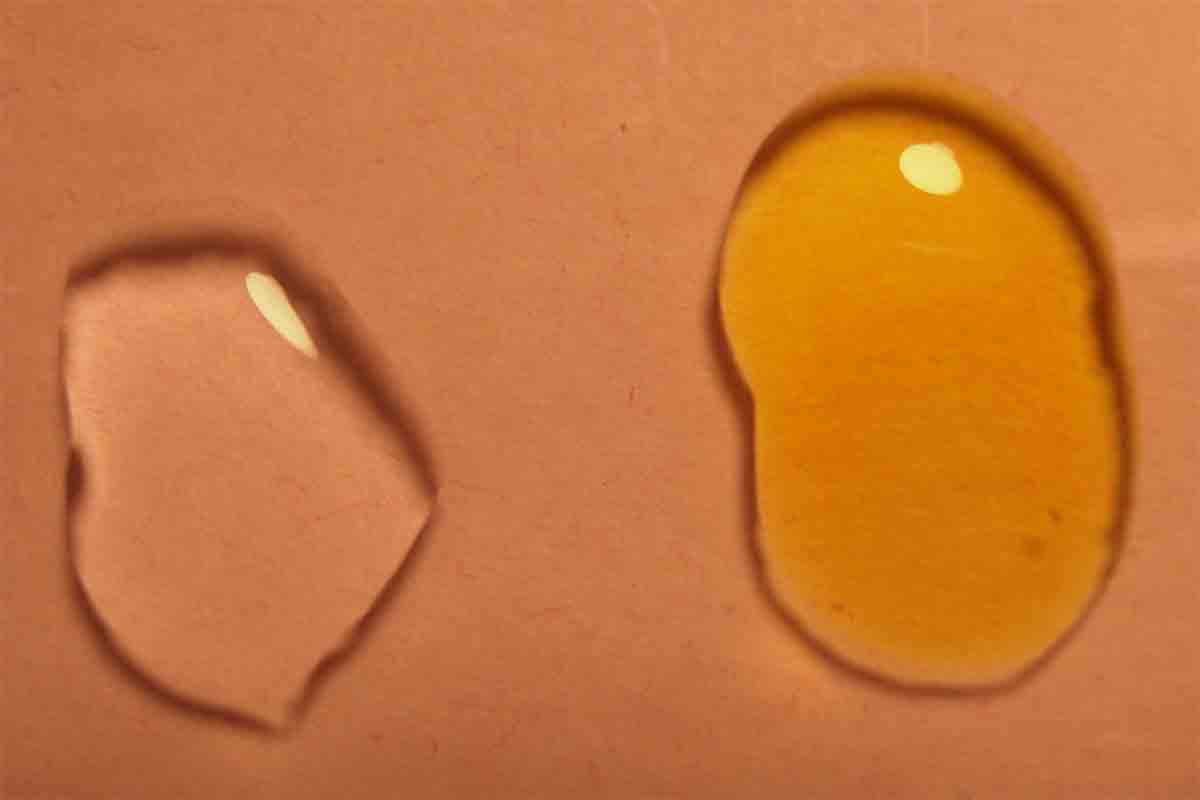
Fig.13

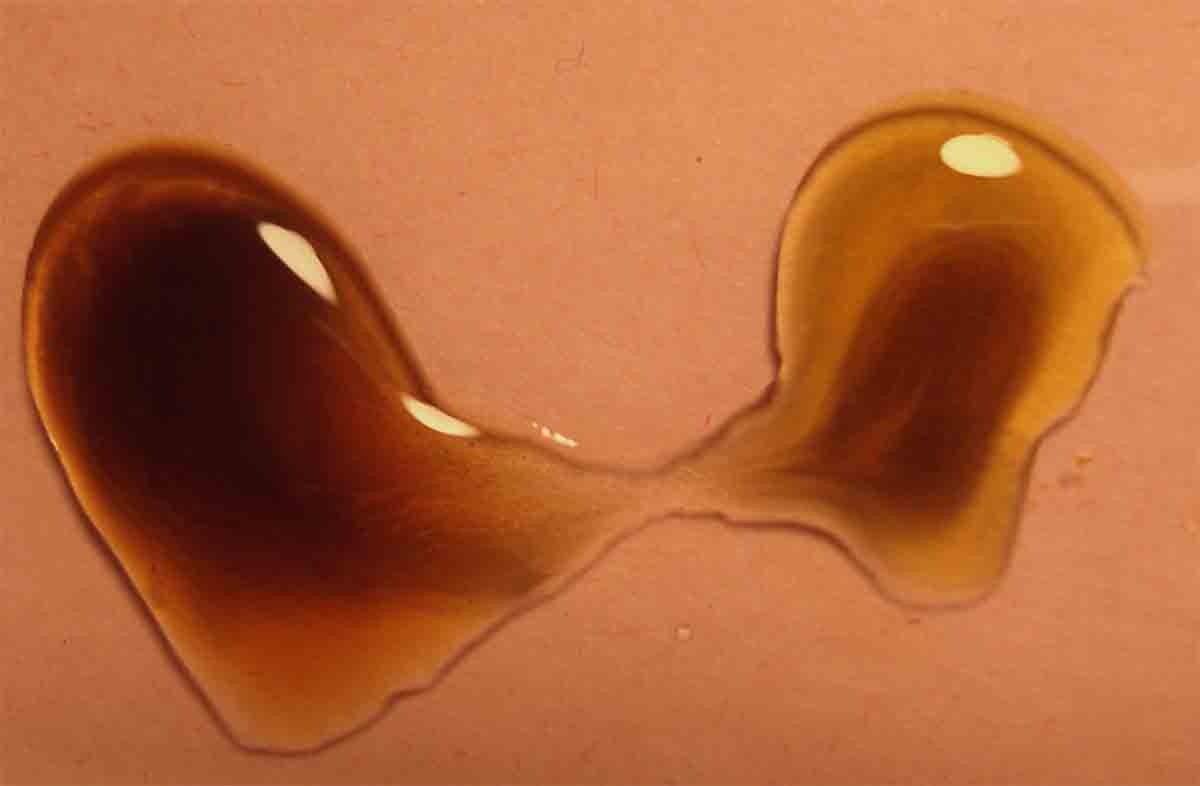
Fig.14

Fig.15
Al mezclarse, se produce la formación de yodo (fig.14) (ligeramente violáceo; su nombre así
lo indica), pero al disolverse en el
yoduro potásico precipita el triyoduro potásico marrón rojizo que se impone
al verdoso del sulfato de cromo(III).
El proceso elemental sería:
K2Cr2O7
+ 6KI+ 7H2SO4 ![]() 4K2SO4+ Cr2(SO4)3+ K2SO4 +7H2O+
3I2
4K2SO4+ Cr2(SO4)3+ K2SO4 +7H2O+
3I2
REDUCC: K2Cr2O7 +
7H2SO4 + 6e- ![]() Cr2(SO4)3 + K2SO4
+ 7 H2O + 3SO4 2-
Cr2(SO4)3 + K2SO4
+ 7 H2O + 3SO4 2-
OXIDAC: 6KI -6e-
![]() 3I2 + 6K+
3I2 + 6K+
____________________________________________________________________
K2Cr2O7
+ 7H2SO4+ 6KI ![]() Cr2(SO4)3
+ K2SO4 + 7 H2O + 3I2
Cr2(SO4)3
+ K2SO4 + 7 H2O + 3I2
naranja
azul verdoso
___________________________________________________________________
3I2 + 3KI ![]() 3I3K
3I3K
Marrón oscuro (precipitado)
dominante
La aparición del triyoduro potásico marrón oscuro, se debe a la gran solubilidad del yodo en yoduro potásico con formación del complejo mencionado. El valor de la constante de equilibrio de este complejo es suficientemente grande como para suponer prácticamente que la totalidad del yodo en disoluciones yoduradas se encuentra en dicho estado. Por lo tanto dicha formación dependerá de la exceso de concentración de KI en la disolución.
e) Una reacción bastante espectacular del dicromato potásico es con hidrógeno sulfito sódico sólido.
Para ella se prepara la gota con dicromato sólido disuelto en una gota de agua destilada y con una gota de ácido sulfúrico 6N
La sucesión de fotos es : 16, 17,18, 19. La 20 es una ampliación.
Fig.16

Fig.17

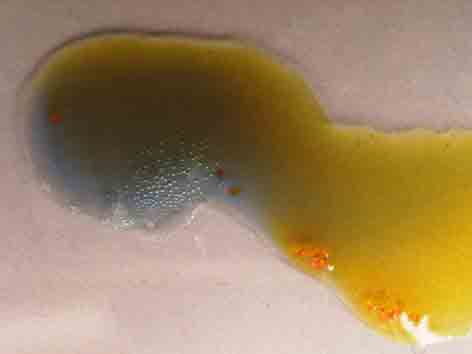
Fig.18

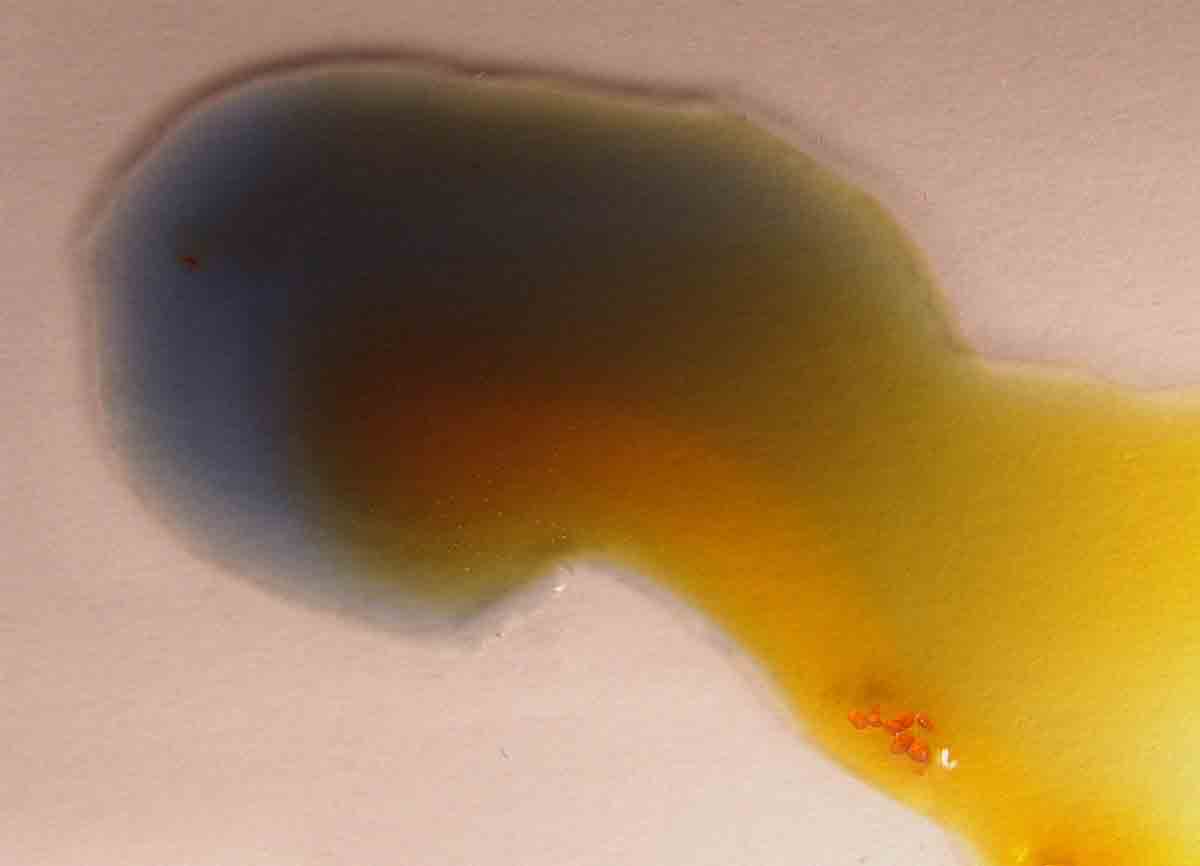
Fig.19
Fig.20

Al mezclarse, se forma el sulfato de cromo(III)
verdoso (con el amarillo parece azul), y la aparición de las burbujas de SO2
características, por la reacción de desplazamiento que tiene lugar con el
ácido sulfúrico.
El proceso redox sería:
K2Cr2O7 + 3NaHSO3+
4H2SO4 ![]() Cr2(SO4)3+ NaHSO4 + K2SO4+
4H2O
Cr2(SO4)3+ NaHSO4 + K2SO4+
4H2O
REDUCC: K2Cr2O7
+ 7H2SO4 + 6e-
= Cr2(SO4)3 + K2SO4
+ 7 H2O + 3SO4 2-
OXIDAC: 3NaHSO3
-6e +3H2O = 3NaHSO4 + 6H+
_________________________________________________________________________
K2Cr2O7 +3NaHSO3
+ 4H2SO4 = Cr2(SO4)3 + K2SO4
+ 4H2O + 3NaHSO4
Naranja
azul
verdoso
[1] La aparición del color azul oscuro se podría interpretar por la formación del complejo ferrocianuro de hierro(III), base del azul de Prusia,