Fig.1
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
ELECTRÓLISIS DEL SULFATO DE CINC(II)
La electrólisis del sulfato de cinc se ha estudiado desde
el punto de vista cualitativo, ahora se va a intentar desvelar, a través de
la fotografía digital, algunos aspectos cuantitativos del proceso, que aparentemente
en algunos casos no siguen las leyes de Faraday.
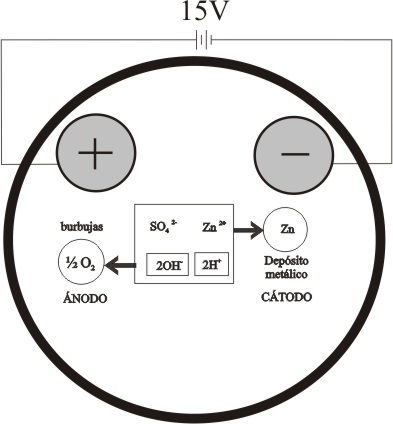
Se emplean electrodos metálicos en todos los procesos,
y se fija la diferencia de potencial en 15V.
En el ánodo se descargará el OH-, y en el
cátodo el Zn2+
Como se indica en la figura 1
Ánodo : 2OH- -2e = ½ O2 (gas) + H2O
Cátodo: Zn2+ + 2e = Zn(s)
quedando en disolución
ácido sulfúrico, que producirá
un pH ácido aunque no tan ácido como cabría esperar, ya que también se descarga el H+, como se verá.
Se va a estudiar el efecto de la concentración de la
disolución en la electrodeposición metálica, tanto en la forma como en el
tiempo para eso se monta un dispositivo de cubeta sobre papel milimetrado,
con un cronómetro que visualizará en cada instante el estado de la electrodeposición(fig.2). El electrodo negativo, donde se produce
la deposición del cinc, se sitúa a la derecha, mientras que el positivo, donde
se desprende el oxígeno está a la izquierda de nuestra vista. La separación
entre ellos es de 60mm.
El cronómetro hasta los treinta minutos visualizará las
centésimas de segundo. A partir de ellos, solo los segundos.
Se preparan 3 disoluciones de sulfato de cinc, 1M, 0,1M
y 0,01M, y se echa sobre una caja petri, en la mínima cantidad para recubrir
su fondo (10mL). Se conecta a una fuente de corriente continua de 15 V.
Para la primera disolución (ZnSO4 1M),
se obtiene la sucesión de fotografías siguiente; fig 2, 3, 4, 5 y 6.
Como lo que nos interesa es la electrodeposición del
cinc, sólo se tomará la zona del cátodo a partir de la 3.

Fig.1
Fig.2
Fig.3
Fig.4
Fig.5
Fig.6
Como se observa en las fotos, la electrodeposición en
estas condiciones enseguida toma forma arborescente, ramificándose rápidamente
hacia el electrodo positivo. El crecimiento no es lineal. En un minuto se
observa un crecimiento longitudinal de 10 mm. Se aprecian las burbujas de
hidrógeno, en la extensión del cátodo a través del cinc metálico (fig. 5 y
6).
Si la disolución es 0,1M, la sucesión
de fotos obtenidas es la siguiente, comenzando por la disposición general
en la caja petri (fig.7) y sucesivamente fig, 8,9 y10.

Fig.7

Fig.8

Fig.9

Fig.10
Como se aprecia la electrodeposición sigue
siendo arborescente aunque no inicialmente como ocurría cuando la concentración
era 1M. Las ramas y seudohojas son aciculares. El desprendimiento de hidrógeno
a través de las ramas de cinc, produce el movimiento de éstas, hasta tal punto
que algunas llegan a romperse. Sólo a partir de los 30 minutos comienza a
tomar forma arborescente tan como la anterior (compárese la situación de ambas
disoluciones a los 15 minutos
(fig.4 y fig.9).
Cuando la concentración es 0,01M,
con un montaje similar, se obtiene la sucesión de fotografías dadas por las
figuras 12, 13, 14, 15, 16, 17, 18 y 19.

Fig.11
Fig.12
Fig.13
Fig.14
Fig.15
Fig.16
Fig.17
Fig.18
Fig.19
Como se aprecia la estructura de la electrodeposición
para el sulfato de cinc 0,01M, es muy diferente a las anteriores. Las ramificaciones
son arbustivas, y las seudohojas no son aciculares. Entre la hora y media
y las tres horas (fig.18 y 19), no
se observa crecimiento; se supone que todo el cinc, se ha depositado.
¿Cuándo se produce el cambio en la forma de la electrodeposición?
Para estudiarlo se preparan disoluciones en el intervalo entre 0,1M y 0,01M,
con concentraciones de 0,08M, 0,05M, 0,04M y 0,02M..
Se fotografían aproximadamente durante un tiempo parecido, y en las mismas
condiciones. Se tomarán en todos los casos fotos a la media y una hora respectivamente.
Fig.20
Fig.21
Fig.22
Fig.23
Fig.24
Fig.25
Fig.26
Fig.27